题目内容
 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中已铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )
铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中已铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )| A、阳极电极方程式为Al-3e+6OH-=Al2O3+H2O |
| B、随着电解的进行,溶液的PH逐渐增大 |
| C、当阴极生成气体3.36L(标况)时,阳极增重2.4g |
| D、电解过程中H+移向Al电极 |
考点:电解原理
专题:电化学专题
分析:A、根据电解质为硫酸溶液可知:在阳极金属铝失去电子生成氧化铝和氢离子,不会有氢氧根离子参与反应;
B、根据电解池工作原理写出总反应,然后判断溶液的pH变化;
C、阴极生成为氢气,计算出氢气的物质的量,然后利用差量法计算出阳极增重的质量;
D、先判断电流方向,然后判断氢离子所带电荷判断氢离子的移动方向.
B、根据电解池工作原理写出总反应,然后判断溶液的pH变化;
C、阴极生成为氢气,计算出氢气的物质的量,然后利用差量法计算出阳极增重的质量;
D、先判断电流方向,然后判断氢离子所带电荷判断氢离子的移动方向.
解答:
解:A、电解质为硫酸溶液,氢氧根离子不可能参加反应,阳极反应为:2Al+3H2O-6e-=
Al2O3+6H+,故A错误;
B、根据原电池装置和题目信息可知电解总反应为:2Al+3H2O
Al2O3+H2↑,水减少,溶液的pH逐渐减小,故B错误;
C、阴极反应为:2H+-2e-=H2↑,氢气的物质的量为:
=0.15mol,则转移的电子的物质的量为:2×0.15mol=0.3mol,阳极反应为:2Al+3H2O-6e-=Al2O3+6H+;根据质量差法进行计算:设阳极增重的质量为x,
2Al+3H2O-6e-=Al2O3 +6H+△m
6mol 48g
0.3mol x
6mol:0.3mol=48g:x,
解得x=2.4g,即阳极增重2.4g,故C正确;
D、根据电流方向可知,阳离子向着阴极移动,铝为阳极,石墨为阴极,所以氢离子向着石墨移动,故D错误;
故选C.
| ||
B、根据原电池装置和题目信息可知电解总反应为:2Al+3H2O
| ||
C、阴极反应为:2H+-2e-=H2↑,氢气的物质的量为:
| 3.36L |
| 22.4L/mol |
2Al+3H2O-6e-=Al2O3 +6H+△m
6mol 48g
0.3mol x
6mol:0.3mol=48g:x,
解得x=2.4g,即阳极增重2.4g,故C正确;
D、根据电流方向可知,阳离子向着阴极移动,铝为阳极,石墨为阴极,所以氢离子向着石墨移动,故D错误;
故选C.
点评:本题考查电解原理、电解方程式的书写及计算,题目难度中等,注意掌握原电池、电解池工作原理,选项C为难点和易错点,注意利用差量法进行计算.

练习册系列答案
相关题目
常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全中和,则下列说法错误的是( )
| A、氨水的浓度等于盐酸的浓度 |
| B、原氨水中有1%的含氮微粒为NH4+ |
| C、氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍 |
| D、混合溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=5×10-4mol?L-1 |
下列有关离子(或物质)的检验及结论正确的是( )
| A、用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
| B、向无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀出现,则溶液中含有SO42ˉ |
| C、向某溶液中滴加少量氯水,再滴加KSCN溶液,若溶液变成血红色,则原溶液中一定有Fe2+ |
| D、向某黄色溶液中加入淀粉溶液,若溶液变蓝色,则原溶液中含有I2 |
下列有关电化学装置的说法正确的是( )
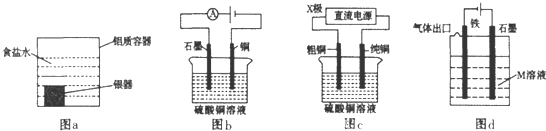

| A、利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-=2Ag+S2- |
| B、图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出 |
| C、图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D、图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
反应A(g)+B(g)═2C(g);△H<0,达到平衡时,下列说法正确的是( )
| A、减小容器体积,平衡不移动 |
| B、加入催化剂,B的转化率增大 |
| C、增大c(A),A的转化率增大 |
| D、降低温度,v正增大,v逆减小 |
 仔细观察下面两种电池的构造示意图,完成下列问题:
仔细观察下面两种电池的构造示意图,完成下列问题: