题目内容
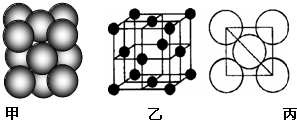
在体积固定的密闭容器中,进行如下化学反应:N2O4(g)?2NO2(g),其化学平衡常数K和温度t的关系如表,请回答下列问题:
(1)该反应的化学平衡常数表达式K= .
(2)该反应为 反应(填“吸热”或“放热”).
(3)判断该反应达到化学平衡状态的依据是 .
A.容器内混合气体密度不变
B.混合气体中c(NO2)不变
C.0.5mol N2O4分解的同时有1mol NO2生成
(4)在80℃时,将2.80molN2O4气体充入2L固定容积的密闭容器中,一段时间后对该容器内的物质进行分析,得到如表数据:
①b的值为 ;
②N2O4的平衡转化率为 ;
③20s~40s内用N2O4表示的平均反应速率υ(N2O4)= .
| t/℃ | 80 | 100 | 120 |
| K | 1.80 | 2.76 | 3.45 |
(2)该反应为
(3)判断该反应达到化学平衡状态的依据是
A.容器内混合气体密度不变
B.混合气体中c(NO2)不变
C.0.5mol N2O4分解的同时有1mol NO2生成
(4)在80℃时,将2.80molN2O4气体充入2L固定容积的密闭容器中,一段时间后对该容器内的物质进行分析,得到如表数据:
| 时间(s) N(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 2.80 | a | 2.00 | c | d | 1.60 |
| n(NO2) | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
②N2O4的平衡转化率为
③20s~40s内用N2O4表示的平均反应速率υ(N2O4)=
考点:化学平衡常数的含义,化学平衡建立的过程,化学平衡状态的判断
专题:化学平衡专题
分析:(1)依据化学方程式和平衡常数概念书写表达式;
(2)图表中平衡常数随温度变化和平衡移动原理分析反应能量变化;
(3)依据化学平衡的标志是正逆反应速率相同,各组分浓度保持不变分析选项;
(4)依据化学平衡三段式列式,结合反应速率概念,转化率计算方法得到.
(2)图表中平衡常数随温度变化和平衡移动原理分析反应能量变化;
(3)依据化学平衡的标志是正逆反应速率相同,各组分浓度保持不变分析选项;
(4)依据化学平衡三段式列式,结合反应速率概念,转化率计算方法得到.
解答:
解:(1)N2O4(g)?2NO2(g),其化学平衡常数K=
;
故答案为:
;
(2)图表中平衡常数随温度升高,平衡常数增大,说明平衡正向进行,正反应是吸热反应;
故答案为:吸热;
(3)反应是气体体积增大的吸热反应,依据化学平衡移动原理分析;
A.混合气体质量守恒,体积不变,容器内混合气体密度在反应过程中和平衡状态下不变,不能说明反应达到平衡状态,故A错误;
B.混合气体中c(NO2)不变,是平衡的标志,故B正确;
C.0.5mol N2O4分解的同时有1mol NO2生成,是表示了反应正向进行,不能说明反应达到平衡状态,故C错误;
故答案为:B;
(4)①依据化学平衡三段式列式;
N2O4(g)?2NO2(g)
起始量(mol) 2.8 0
变化量(mol) 0.8 1.60
40s(mol) 2.0 1.60
b=1.60mol;
故答案为:1.60;
②图表中分析80s-100S达到平衡状态,N2O4的平衡转化率=
×100%=42.9%;
故答案为:42.9%;
③20s~40s内计算NO2的反应速率=
=0.016mol/L?s,速率之比等于化学方程式系数之比,用N2O4表示的平均反应速率υ(N2O4)=
υ(NO2)=0.008mol/L?s;
故答案为:0.008 mol?L-1?s-1.
| [NO2]2 |
| [N2O4] |
故答案为:
| [NO2]2 |
| [N2O4] |
(2)图表中平衡常数随温度升高,平衡常数增大,说明平衡正向进行,正反应是吸热反应;
故答案为:吸热;
(3)反应是气体体积增大的吸热反应,依据化学平衡移动原理分析;
A.混合气体质量守恒,体积不变,容器内混合气体密度在反应过程中和平衡状态下不变,不能说明反应达到平衡状态,故A错误;
B.混合气体中c(NO2)不变,是平衡的标志,故B正确;
C.0.5mol N2O4分解的同时有1mol NO2生成,是表示了反应正向进行,不能说明反应达到平衡状态,故C错误;
故答案为:B;
(4)①依据化学平衡三段式列式;
N2O4(g)?2NO2(g)
起始量(mol) 2.8 0
变化量(mol) 0.8 1.60
40s(mol) 2.0 1.60
b=1.60mol;
故答案为:1.60;
②图表中分析80s-100S达到平衡状态,N2O4的平衡转化率=
| 2.8mol-1.60mol |
| 2.80mol |
故答案为:42.9%;
③20s~40s内计算NO2的反应速率=
| ||
| 40s-20s |
| 1 |
| 2 |
故答案为:0.008 mol?L-1?s-1.
点评:本题考查了化学平衡影响因素,平衡标志的理解,平衡常数计算分析、反应速率、转化率概念的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
化学与生活是紧密相联的,下列关于生活与化学的说法不正确的是( )
| A、从海水提取物质不一定都必须通过化学反应才能实现 |
| B、大量的氮、磷废水排入海洋,易引发赤潮 |
| C、为了防止中秋月饼等富脂食品氧化变质,延长食品保质期,在包装袋中常放入生石灰 |
| D、保护加酶洗衣粉的洗涤效果,应用温水溶解洗衣粉 |
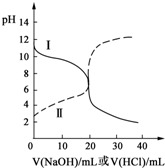 25℃时,取浓度均为0.1000mol?L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol?L-1NaOH溶液、0.1000mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1000mol?L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol?L-1NaOH溶液、0.1000mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )| A、根据滴定曲线可得,25℃时 Ka(CH3COOH)≈Kb(NH3?H2O)≈10-5 |
| B、当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交 |
| C、曲线Ⅱ:滴加溶液到10.00 mL时,溶液中c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
| D、在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小 |
比较下列各组微粒半径,正确的是( )
①Cl<Cl-<Br-②F-<Mg2+<Al3+③Na+<Na<K ④S2-<Cl-<Br-.
①Cl<Cl-<Br-②F-<Mg2+<Al3+③Na+<Na<K ④S2-<Cl-<Br-.
| A、①和③ | B、只有② |
| C、只有③ | D、①和④ |
 高炉炼铁过程中发生的反应:
高炉炼铁过程中发生的反应: