题目内容
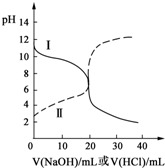 25℃时,取浓度均为0.1000mol?L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol?L-1NaOH溶液、0.1000mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1000mol?L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol?L-1NaOH溶液、0.1000mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )| A、根据滴定曲线可得,25℃时 Ka(CH3COOH)≈Kb(NH3?H2O)≈10-5 |
| B、当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交 |
| C、曲线Ⅱ:滴加溶液到10.00 mL时,溶液中c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
| D、在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:根据曲线变化趋势知,当未滴加溶液时,曲线I的pH>7,说明属于酸滴定碱溶液,根据曲线变化趋势知,当未滴加溶液时,曲线II的pH<7,说明属于碱滴定酸溶液,
A.根据图象可知,0.1000mol/L的醋酸的pH约为3,0.1000mol/L的氨水的pH约为11,据此计算出 Ka(CH3COOH)、Kb(NH3?H2O);
B.二者反应恰好生成醋酸钠和氯化铵,溶液分别为碱性、酸性,所以曲线Ⅰ和Ⅱ不会相交;
C.曲线Ⅱ:滴加溶液到10.00 mL时,溶质为等物质的量的醋酸和醋酸钠,根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)、物料守恒c(CH3COOH)+c(CH3COO-)=2c(Na+)及此时溶液显示酸性进行判断;
D.在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,滴定前溶液为酸性或者碱性,随着中和反应的进行,溶液中氢离子或者氢氧根离子浓度逐渐减小,水的电离程度逐渐增大;中和反应之后溶液中氢离子或者氢氧根离子浓度逐渐增大,溶液中水电离程度逐渐减小.
A.根据图象可知,0.1000mol/L的醋酸的pH约为3,0.1000mol/L的氨水的pH约为11,据此计算出 Ka(CH3COOH)、Kb(NH3?H2O);
B.二者反应恰好生成醋酸钠和氯化铵,溶液分别为碱性、酸性,所以曲线Ⅰ和Ⅱ不会相交;
C.曲线Ⅱ:滴加溶液到10.00 mL时,溶质为等物质的量的醋酸和醋酸钠,根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)、物料守恒c(CH3COOH)+c(CH3COO-)=2c(Na+)及此时溶液显示酸性进行判断;
D.在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,滴定前溶液为酸性或者碱性,随着中和反应的进行,溶液中氢离子或者氢氧根离子浓度逐渐减小,水的电离程度逐渐增大;中和反应之后溶液中氢离子或者氢氧根离子浓度逐渐增大,溶液中水电离程度逐渐减小.
解答:
解:根据曲线变化趋势知,当未滴加溶液时,曲线I的pH>7,说明属于酸滴定碱溶液,根据曲线变化趋势知,当未滴加溶液时,曲线II的pH<7,说明属于碱滴定酸溶液,
A.结合图象可知,0.1000mol/L的醋酸的pH约为3,溶液中氢离子浓度为0.001mol/L,Ka(CH3COOH)=
=
≈10-5;0.1000mol/L的氨水的pH约为11,氢氧根离子浓度为0.001mol/L,Kb(NH3?H2O)=
=
≈10-5,故A正确;
B.当NaOH溶液和盐酸滴加至20.00mL时,氢氧化钠与醋酸反应生成醋酸钠,溶液显示碱性,溶液的pH>7;盐酸与氨水反应生成氯化铵,溶液显示酸性,溶液的pH<7,所以曲线Ⅰ和Ⅱ一定不会相交,故B错误;
C.曲线Ⅱ:滴加溶液到10.00 mL时,溶质为等物质的量的醋酸钠和醋酸,根据物料守恒可得:c(CH3COOH)+c(CH3COO-)=2c(Na+),由于醋酸的电离程度大于醋酸根离子的水解程度,则溶液中溶液中c(CH3COOH)<c(Na+)<c(CH3COO-);根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),由于c(CH3COOH)<c(Na+),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故C正确;
D.酸溶液和碱溶液中都抑制了水的电离,两个滴定过程中,溶液的酸性(或碱性)逐渐减弱,水电离程度逐渐增大,之后滴入的碱(或酸)过量,溶液的碱性(或酸性)逐渐增强,水的电离程度有开始逐渐减小,故D正确;
故选B.
A.结合图象可知,0.1000mol/L的醋酸的pH约为3,溶液中氢离子浓度为0.001mol/L,Ka(CH3COOH)=
| c(H+)?c(CHC3OO-) |
| c(CH3COOH) |
| 10-3×10-3 |
| 0.1000-10-3 |
c(N
| ||
| c(NH3?H2O) |
| 10-3×10-3 |
| 0.1000-10-3 |
B.当NaOH溶液和盐酸滴加至20.00mL时,氢氧化钠与醋酸反应生成醋酸钠,溶液显示碱性,溶液的pH>7;盐酸与氨水反应生成氯化铵,溶液显示酸性,溶液的pH<7,所以曲线Ⅰ和Ⅱ一定不会相交,故B错误;
C.曲线Ⅱ:滴加溶液到10.00 mL时,溶质为等物质的量的醋酸钠和醋酸,根据物料守恒可得:c(CH3COOH)+c(CH3COO-)=2c(Na+),由于醋酸的电离程度大于醋酸根离子的水解程度,则溶液中溶液中c(CH3COOH)<c(Na+)<c(CH3COO-);根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),由于c(CH3COOH)<c(Na+),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故C正确;
D.酸溶液和碱溶液中都抑制了水的电离,两个滴定过程中,溶液的酸性(或碱性)逐渐减弱,水电离程度逐渐增大,之后滴入的碱(或酸)过量,溶液的碱性(或酸性)逐渐增强,水的电离程度有开始逐渐减小,故D正确;
故选B.
点评:本题考查了酸碱混合后的定性判断及溶液的酸碱性与溶液pH的关系,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒及盐的水解判断溶液中离子浓度大小.

练习册系列答案
相关题目
能用H++OH-=H2O表示的反应是( )
| A、氢氧化钡溶液与硫酸反应 |
| B、氢氧化铜与稀硝酸反应 |
| C、氢氧化钾与稀盐酸反应 |
| D、氢氧化钠与醋酸溶液反应 |
 天然维生素P(结构如图,其中烃基R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
天然维生素P(结构如图,其中烃基R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )| A、可以使酸性KMnO4溶液褪色 |
| B、分子中有三个苯环 |
| C、1mol维生素P可以和4mol NaOH反应 |
| D、维生素P与溴水反应时1mol维生素P可以消耗6mol Br2 |
下列说法中不正确的是( )
| A、乙烯与苯都能使溴水褪色,但褪色原理不同 |
| B、1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol |
| C、溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 |
D、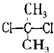 与 与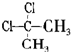 互为同分异构体 互为同分异构体 |
下列反应的离子方程式正确的是( )
| A、NaAlO2溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |
| B、碘水中通入适量的SO2:I2+SO2+2H2O═2HI+SO42-+2H+ |
| C、FeSO4溶液中滴加双氧水:2Fe2++2H2O2═2Fe3++O2↑+2H2O |
| D、Na2CO3发生水解反应:CO32-+2H2O═H2CO3+2OH- |
下列叙述中,不正确的是( )
| A、pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1:10 |
| B、1.0mol/L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| C、仅含Na+、H+、OH-、CH3COO-离子的某溶液中可能存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、0.1mol/L的CH3COOH溶液中,由水电离出的c(H+)为1×10-13mol/L |