题目内容
在电解炼铝过程中加入冰晶石(用“A”)代替,可起到降低Al2O3熔点的作用.冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2A+3CO2↑+9H2O.根据题意完成下列填空:
(1)冰晶石的化学式为 ,含有离子键、 等化学键
(2)生成物中含有10个电子的分子空间构型为 ,中心原子的杂化方式为
(3)反应物中电负性最大的元素为 (填元素符号),写出其原子最外层的电子排布图
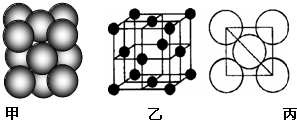
(4)Al单质的晶体中原子堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置的平面图如图丙所示.若已知Al的原子半径为d,NA代表阿伏加德罗常数.Al的相对原子质量为M.则一个晶胞中Al的原子个数为 ;Al晶体的密度为 (用字母表示)

(1)冰晶石的化学式为
(2)生成物中含有10个电子的分子空间构型为
(3)反应物中电负性最大的元素为
(4)Al单质的晶体中原子堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置的平面图如图丙所示.若已知Al的原子半径为d,NA代表阿伏加德罗常数.Al的相对原子质量为M.则一个晶胞中Al的原子个数为
考点:化学键,元素电离能、电负性的含义及应用,判断简单分子或离子的构型,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)冰晶石是六氟合铝酸钠,化学式Na3AlF6;六氟合铝(Ⅲ)酸根离子中含有配位键;
(2)根据方程式可知生成物10电子的物质是水,依据水分子的空间构型解答;
(3)元素非金属性越强电负性越大,依据F最外层电子排布可画出电子排布图;
(4)依据Al单质的晶体中原子堆积方式图解答.
(2)根据方程式可知生成物10电子的物质是水,依据水分子的空间构型解答;
(3)元素非金属性越强电负性越大,依据F最外层电子排布可画出电子排布图;
(4)依据Al单质的晶体中原子堆积方式图解答.
解答:
解:(1)冰晶石的化学式为Na3AlF6,Na+与AlF之间为离子键,而AlF是以配位键形成的;
故答案为:Na3AlF6;配位键;
(2)生成物中10电子分子是H2O,氧原子采取sp3杂化,由于氧原子外含有两对孤对电子,故分子结构为V形;
故答案为:V形; sp3;
(3)F是电负性最大的元素,其最外层电子排布图为 ;
;
故答案为:F; ;
;
(4)铝晶胞的原子处于晶胞顶点和面心,故一个晶胞含有的Al原子数目为6×
+8×
=4;设Al晶胞的边长为a,则有:2a2=(4d)2,a=2
d,Al晶胞的体积为V=16
d3 ,故Al晶体的密度为
.
故答案为:4;
.
故答案为:Na3AlF6;配位键;
(2)生成物中10电子分子是H2O,氧原子采取sp3杂化,由于氧原子外含有两对孤对电子,故分子结构为V形;
故答案为:V形; sp3;
(3)F是电负性最大的元素,其最外层电子排布图为
 ;
;故答案为:F;
 ;
;(4)铝晶胞的原子处于晶胞顶点和面心,故一个晶胞含有的Al原子数目为6×
| 1 |
| 2 |
| 1 |
| 8 |
| 2 |
| 2 |
| M | ||
4
|
故答案为:4;
| M | ||
4
|
点评:本题考查了化学键,电负性、分子的空间构型,原子轨道的杂化方式、晶胞的计算,题目综合性强,难度大,看清晶胞的示意图是晶胞计算的解题关键.

练习册系列答案
相关题目
能用H++OH-=H2O表示的反应是( )
| A、氢氧化钡溶液与硫酸反应 |
| B、氢氧化铜与稀硝酸反应 |
| C、氢氧化钾与稀盐酸反应 |
| D、氢氧化钠与醋酸溶液反应 |
下列叙述中,不正确的是( )
| A、pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1:10 |
| B、1.0mol/L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| C、仅含Na+、H+、OH-、CH3COO-离子的某溶液中可能存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、0.1mol/L的CH3COOH溶液中,由水电离出的c(H+)为1×10-13mol/L |
 而不是
而不是 ,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是
,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是 某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题: (14分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
(14分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表: