题目内容
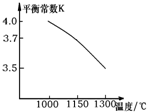 高炉炼铁过程中发生的反应:
高炉炼铁过程中发生的反应:| 1 |
| 3 |
| 2 |
| 3 |
①△H>0
②1000℃时,充入2mol Fe2O3和3mol CO,达到平衡时,CO的转化率为80%
③其它条件不变,压缩体积,可以提高炼铁的工作效率
④工业上冶炼56吨铁,至少需要42吨CO气体.
| A、1个 | B、2个 | C、3个 | D、4个 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:①图象分析平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正反应为放热反应;
②1000℃时K=4,结合化学平衡列式计算判断;
③压缩体积增大压强,平衡不动,缩短达到平衡的时间;
④依据化学方程式定量关系计算.
②1000℃时K=4,结合化学平衡列式计算判断;
③压缩体积增大压强,平衡不动,缩短达到平衡的时间;
④依据化学方程式定量关系计算.
解答:
解:①图象分析平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正反应为放热反应,△H<0,故①错误;
②1000℃时,K=4,充入2mol Fe2O3和3mol CO,达到平衡时,设消耗一氧化碳物质的量为x,
Fe2O3(s)+CO(g)?
Fe(s)+CO2(g),
起始量(mol) 3 0
变化量(mol) x x
平衡量(mol) 3-x x
=4
x=2.4
CO的转化率=
×100%=80%,故②正确;
③其它条件不变,压缩体积,增大反应速率但不改变化学平衡状态,缩短反应时间,可以提高炼铁的工作效率,故③正确;
④工业上冶炼56吨铁,依据化学方程式计算
Fe2O3(s)+CO(g)?
Fe(s)+CO2(g),
28
×56
42t 56t
反应是可逆反应,需要CO气体质量大于42吨,故④错误;
故选B.
②1000℃时,K=4,充入2mol Fe2O3和3mol CO,达到平衡时,设消耗一氧化碳物质的量为x,
| 1 |
| 3 |
| 2 |
| 3 |
起始量(mol) 3 0
变化量(mol) x x
平衡量(mol) 3-x x
| x |
| 3-x |
x=2.4
CO的转化率=
| 2.4mol |
| 3mol |
③其它条件不变,压缩体积,增大反应速率但不改变化学平衡状态,缩短反应时间,可以提高炼铁的工作效率,故③正确;
④工业上冶炼56吨铁,依据化学方程式计算
| 1 |
| 3 |
| 2 |
| 3 |
28
| 2 |
| 3 |
42t 56t
反应是可逆反应,需要CO气体质量大于42吨,故④错误;
故选B.
点评:本题考查了化学平衡影响因素,化学平衡转化率计算分析,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
关于下列各装置图的叙述中,正确的是( )
A、 制取及观察Fe(OH)2 |
B、 比较两种物质的稳定性 |
C、 实验室制取NH3 |
D、 分离沸点不同且互溶的液体混合物 |
 天然维生素P(结构如图,其中烃基R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
天然维生素P(结构如图,其中烃基R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )| A、可以使酸性KMnO4溶液褪色 |
| B、分子中有三个苯环 |
| C、1mol维生素P可以和4mol NaOH反应 |
| D、维生素P与溴水反应时1mol维生素P可以消耗6mol Br2 |
下列反应的离子方程式正确的是( )
| A、NaAlO2溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |
| B、碘水中通入适量的SO2:I2+SO2+2H2O═2HI+SO42-+2H+ |
| C、FeSO4溶液中滴加双氧水:2Fe2++2H2O2═2Fe3++O2↑+2H2O |
| D、Na2CO3发生水解反应:CO32-+2H2O═H2CO3+2OH- |
下列叙述中,不正确的是( )
| A、pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1:10 |
| B、1.0mol/L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| C、仅含Na+、H+、OH-、CH3COO-离子的某溶液中可能存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、0.1mol/L的CH3COOH溶液中,由水电离出的c(H+)为1×10-13mol/L |