题目内容
8.常温时,下列叙述正确的是( )| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 一定浓度的CH3COOH和NaOH混合,溶液呈中性,则混合液中c(H+)═$\sqrt{{K}_{W}}$mol/L | |
| C. | pH均为11的NaOH和NH3•H2O溶液中,水的电离程度不相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
分析 A.稀释醋酸,促进电离,氢离子的浓度减小,Kw不变;
B.溶液呈中性,c(H+)=c(OH-);
C.c(OH-)相同,对水的抑制相同;
D.pH与体积均相同的硫酸和醋酸,如pH均为1,醋酸浓度大于0.1mol/L,硫酸为0.05mol/L.
解答 解:A.稀释醋酸,促进电离,氢离子的浓度减小,Kw不变,则溶液中c(OH-)增大,故A错误;
B.溶液呈中性,c(H+)=c(OH-)=$\sqrt{{K}_{W}}$mol/L,故B正确;
C.pH均为11的NaOH和NH3•H2O溶液中c(OH-)相同,对水的抑制相同,水的电离程度相同,故C错误;
D.pH与体积均相同的硫酸和醋酸,如pH均为1,醋酸浓度大于0.1mol/L,硫酸为0.05mol/L,则醋酸消耗氢氧化钠的物质的量多,故D错误;
故选B.
点评 本题考查弱电解质的电离及酸碱混合,为高频考点,把握弱电解质的电离、酸碱中和反应为解答的关键,侧重分析与应用能力的考查,注意溶液的浓度、pH的关系,题目难度不大.

练习册系列答案
相关题目
2.下列物质间的变化,不能通过与氧气反应一步完成的是( )
| A. | N2→NO2 | B. | Na→Na2O2 | C. | SO2→SO3 | D. | Fe→Fe3O4 |
16.已知A+.B2+.C-.D2-为同周期主族元素的离子,则下列叙述正确的是( )
| A. | 离子半径:D>C>B>A | |
| B. | 原子序数:D>C>B>A | |
| C. | 原子半径:A>B>C>D | |
| D. | 最高价氧化物的水化物碱性:A>B,酸性:C>D |
3.下列离子方程式与所述事实相符且正确的是( )
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用FeCl3溶液腐蚀铜板制印刷电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 向NaAlO2溶液中通入少量CO2制Al(OH)3:AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓ | |
| D. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
13.图1是电解饱和氯化钠溶液示意图.图2中,x轴表示实验时流入阴极的电子的物质的量,y轴表示( )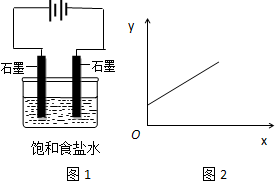

| A. | n(Na+) | B. | n(Cl-) | C. | c(OH-) | D. | c(H+) |
20.乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
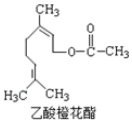

| A. | 分子式为 C12H22O2 | |
| B. | 1mol 该有机物水解时只能消耗 1 mol NaOH | |
| C. | 能使酸性 KMnO4溶液褪色,能发生加成反应,但不能发生取代反应 | |
| D. | 1mol 该有机物在一定条件下和 H2反应,共消耗 H2 为 3mol |
17.某化学反应 3A?2B+D在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验 1,反应在10min~20min 内用D的浓度变化表示的平均速率为0.01mol/(L•min).
(2)在实验 2,A 的初始浓度 c2为2.0mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且c3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是升高温度平衡向逆向移动,所以正反应是放热反应.
| 实验 序号 | t/min C/mol•L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1,反应在10min~20min 内用D的浓度变化表示的平均速率为0.01mol/(L•min).
(2)在实验 2,A 的初始浓度 c2为2.0mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且c3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是升高温度平衡向逆向移动,所以正反应是放热反应.
18.下列离子方程式正确的是( )
| A. | 铁与盐酸的反应:2Fe+6H +═2Fe 3 ++3 H 2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO 3+2H +═Ca 2 ++2H 2O+CO 2↑ | |
| C. | 铜片插入硝酸银溶液:Cu+Ag +═Cu 2++Ag | |
| D. | 钠与水反应::2Na+2H 2O═2OH -+2Na ++H 2↑ |
