题目内容
2.下列物质间的变化,不能通过与氧气反应一步完成的是( )| A. | N2→NO2 | B. | Na→Na2O2 | C. | SO2→SO3 | D. | Fe→Fe3O4 |
分析 A.氮气和氧气反应生成NO;
B.钠在空气中燃烧生成过氧化钠;
C.二氧化硫和氧气在催化剂、加热条件下反应生成三氧化硫;
D.铁和水蒸气或在氧气中燃烧都生成四氧化三铁.
解答 解:A.在放电条件下,氮气和氧气反应生成NO,NO不稳定,易被氧气氧化生成二氧化氮,所以氮气不能一步生成二氧化氮,故A选;
B.钠在空气中燃烧生成过氧化钠,所以能一步实现,故B不选;
C.二氧化硫和氧气在催化剂、加热条件下反应生成三氧化硫,所以能一步实现,故C不选;
D.铁和水蒸气或在氧气中燃烧都生成四氧化三铁,所以能一步实现,故D不选;
故选A.
点评 本题考查元素化合物性质,为高频考点,明确物质性质、物质之间的转化是解本题关键,侧重考查学生对基础知识的掌握,注意D中铁能和水蒸气反应,但铁和液态水不反应.

练习册系列答案
相关题目
13.下列物质中,既含离子键又含极性共价键的是( )
| A. | NaCl | B. | H2 | C. | H2O | D. | NaOH |
17.已知A是碳元素,B是氧元素,C是钠元素,D是铝元素,下列说法正确的是( )
| A. | 原子半径:C>A | |
| B. | 气态氢化物的稳定性:A>B | |
| C. | 四种元素在同一周期 | |
| D. | 最高价氧化物对应水化物的碱性:C<D |
7.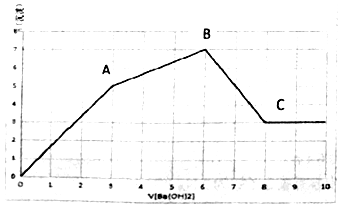 向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )
 向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )| A. | OA段反应的离子方程式为Al3++3OH-+Ba2++SO42-=Al(OH)3↓+BaSO4↓ | |
| B. | B点对应的溶液中,Na+、CO32-、NO3-可以大量共存 | |
| C. | C点对应的溶液中,通入过量的CO2气体有白色沉淀生成 | |
| D. | 原溶液中Al2(SO4)3和AlCl3的物质的量之比为1:1 |
8.常温时,下列叙述正确的是( )
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 一定浓度的CH3COOH和NaOH混合,溶液呈中性,则混合液中c(H+)═$\sqrt{{K}_{W}}$mol/L | |
| C. | pH均为11的NaOH和NH3•H2O溶液中,水的电离程度不相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
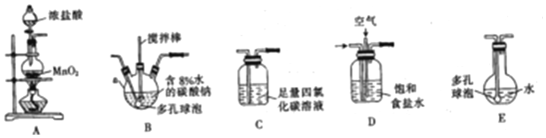
 一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验
一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验 保证食品安全、保持营养均衡、合理用药是保障人体健康的基础.
保证食品安全、保持营养均衡、合理用药是保障人体健康的基础.