题目内容
16.已知A+.B2+.C-.D2-为同周期主族元素的离子,则下列叙述正确的是( )| A. | 离子半径:D>C>B>A | |
| B. | 原子序数:D>C>B>A | |
| C. | 原子半径:A>B>C>D | |
| D. | 最高价氧化物的水化物碱性:A>B,酸性:C>D |
分析 A+、B2+、C-、D2-为同周期主族元素的离子,则原子序数为C>D>B>A,结合同周期元素的性质变化规律来解答.
解答 解:A.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则离子半径:D>C>A>B,故A错误;
B.为同周期元素,则原子序数为C>D>B>A,故B错误;
C.同周期从左向右原子半径减小,则原子半径:A>B>D>C,故C错误;
D.同周期从左向右金属性减弱、非金属性增强,则最高价氧化物的水化物碱性:A>B,酸性:C>D,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素周期律为解答的关键,侧重分析与应用能力的考查,注意同周期元素性质,题目难度不大.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
7.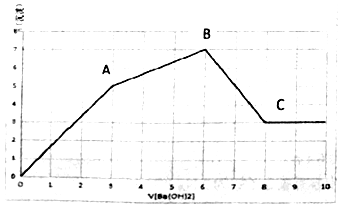 向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )
 向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )| A. | OA段反应的离子方程式为Al3++3OH-+Ba2++SO42-=Al(OH)3↓+BaSO4↓ | |
| B. | B点对应的溶液中,Na+、CO32-、NO3-可以大量共存 | |
| C. | C点对应的溶液中,通入过量的CO2气体有白色沉淀生成 | |
| D. | 原溶液中Al2(SO4)3和AlCl3的物质的量之比为1:1 |
1.铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2.下列有关该电池的说法不正确的是( )
| A. | 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe | |
| B. | 电池放电时,负极反应为Fe-2e-═Fe2+ | |
| C. | 电池充电过程中,阴极附近溶液的pH升高 | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
8.常温时,下列叙述正确的是( )
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 一定浓度的CH3COOH和NaOH混合,溶液呈中性,则混合液中c(H+)═$\sqrt{{K}_{W}}$mol/L | |
| C. | pH均为11的NaOH和NH3•H2O溶液中,水的电离程度不相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
5.2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现.某反应在Pd/Al2O3/Ba催化剂表面吸附与解吸作用的机理如图所示,(图中HC表示碳氢化合物,nitrate指硝酸盐)
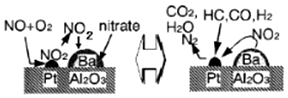
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 该机理研究的是汽车尾气催化转化机理 | |
| B. | CO在催化剂表面被还原生成CO2,铂起催化作用 | |
| C. | CO在催化剂表面可能和O2、NO反应 | |
| D. | NO、CO均能与人体中的血红蛋白结合 |
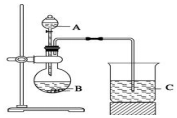 一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验
一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验
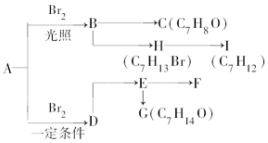 A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体:
A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体: ,
, .
.