题目内容
18.下列离子方程式正确的是( )| A. | 铁与盐酸的反应:2Fe+6H +═2Fe 3 ++3 H 2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO 3+2H +═Ca 2 ++2H 2O+CO 2↑ | |
| C. | 铜片插入硝酸银溶液:Cu+Ag +═Cu 2++Ag | |
| D. | 钠与水反应::2Na+2H 2O═2OH -+2Na ++H 2↑ |
分析 A.铁与盐酸反应生成的是亚铁离子;
B.醋酸为弱酸,离子方程式中醋酸不能拆开;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.钠与水反应生成氢氧化钠和氢气.
解答 解:A.铁与盐酸的反应生成氯化亚铁和氢气,正确的离子方程式为:Fe+2H +═2Fe2++H 2↑,故A错误;
B.碳酸钙和醋酸都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.铜片插入硝酸银溶液,反应生成硝酸铜和银,正确的离子方程式为:Cu+2Ag+═Cu2++2Ag,故C错误;
D.钠与水反应生成NaOH和氢气,反应的离子方程式为:2Na+2H2O═2OH -+2Na++H 2↑,故D正确;
故选D.
点评 本题考查了离子方程式的判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
8.常温时,下列叙述正确的是( )
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 一定浓度的CH3COOH和NaOH混合,溶液呈中性,则混合液中c(H+)═$\sqrt{{K}_{W}}$mol/L | |
| C. | pH均为11的NaOH和NH3•H2O溶液中,水的电离程度不相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
9. 某50mL溶液中可能含有H+、Na+、Mg2+、Al3+、SO42-、NH4+离子,当向该溶液中加入5mol/L的NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积v(NaOH)变化关系如图所示.( )
某50mL溶液中可能含有H+、Na+、Mg2+、Al3+、SO42-、NH4+离子,当向该溶液中加入5mol/L的NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积v(NaOH)变化关系如图所示.( )
 某50mL溶液中可能含有H+、Na+、Mg2+、Al3+、SO42-、NH4+离子,当向该溶液中加入5mol/L的NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积v(NaOH)变化关系如图所示.( )
某50mL溶液中可能含有H+、Na+、Mg2+、Al3+、SO42-、NH4+离子,当向该溶液中加入5mol/L的NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积v(NaOH)变化关系如图所示.( )| A. | 原溶液中一定含有的阳离子是H+、Mg2+、Al3+ | |
| B. | 原溶液中Al3+的浓度为lmol/L | |
| C. | 原溶液中NH4+的物质的量为0.4 mol | |
| D. | 当加入的NaOH溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42- |
3.向1L含0.1mol/LNaAlO2和0.2mol/LNaOH的溶液中缓缓通入二氧化碳,随n(CO2)增大,先后发生三个反应.已知酸性:H2CO3>HCO3->Al(OH)3.下列说法正确的是( )
| A. | n(CO2)=0.1时,c(Na+)>c(AlO2-)>c(CO32-)>c(OH-) | |
| B. | 0.1mol<n(CO2)<0.15时发生的反应是:Na2CO3+CO2+H2O═2NaHCO3 | |
| C. | n(CO2)=0.15时,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| D. | n(CO2)=0.3时,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
10.下列离子方程式的书写正确的是( )
| A. | 醋酸溶液与氨水混合:CH3COOH+NH3•H2O═CH3COO-+NH4++H2O | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| C. | 常温下C12与NaOH溶液反应:Cl2+2OH-═C1-+C1O-+H2O | |
| D. | 氢氧化钡溶液中加入稀硫酸:Ba2++SO42-═BaSO4↓ |
8.进行一氯取代后,只生成三种沸点不同的产物的烷烃是( )
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)2CCH2CH3 |
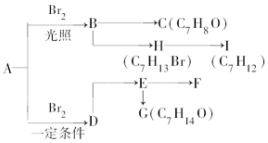 A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体:
A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体: ,
, .
.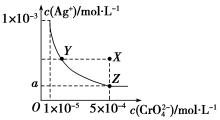 图是铬酸银(Ag2CrO4)T℃时,在水溶液中的沉淀溶解平衡曲线.
图是铬酸银(Ag2CrO4)T℃时,在水溶液中的沉淀溶解平衡曲线.