题目内容
13.图1是电解饱和氯化钠溶液示意图.图2中,x轴表示实验时流入阴极的电子的物质的量,y轴表示( )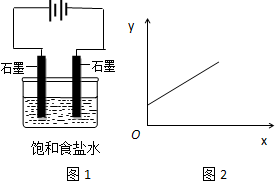
| A. | n(Na+) | B. | n(Cl-) | C. | c(OH-) | D. | c(H+) |
分析 惰性电极电极食盐水时,阳极电极反应为:2Cl--2e-=Cl2↑,阴极电极反应为2H++2e-=H2↑,电解反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,图2中y随x的增大而增大,以此来解答.
解答 解:A.电解中n(Na+)不变,故A不选;
B.阳极电极反应为2Cl--2e-=Cl2↑,n(Cl-)减小,故B不选;
C.阴极电极反应为2H++2e-=H2↑,阴极负极c(OH-)增大,则x轴表示实验时流入阴极的电子的物质的量,y轴表示c(OH-),故C选;
D.阴极电极反应为2H++2e-=H2↑,c(H+)减小,故D不选;
故选C.
点评 本题考查电解原理,为高频考点,把握发生的电解反应、电极反应、图中量的关系为解答的关键,侧重分析与应用能力的考查,注意电解时离子的放电顺序,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2.下列有关该电池的说法不正确的是( )
| A. | 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe | |
| B. | 电池放电时,负极反应为Fe-2e-═Fe2+ | |
| C. | 电池充电过程中,阴极附近溶液的pH升高 | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
8.常温时,下列叙述正确的是( )
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 一定浓度的CH3COOH和NaOH混合,溶液呈中性,则混合液中c(H+)═$\sqrt{{K}_{W}}$mol/L | |
| C. | pH均为11的NaOH和NH3•H2O溶液中,水的电离程度不相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
5.2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现.某反应在Pd/Al2O3/Ba催化剂表面吸附与解吸作用的机理如图所示,(图中HC表示碳氢化合物,nitrate指硝酸盐)
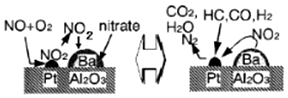
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 该机理研究的是汽车尾气催化转化机理 | |
| B. | CO在催化剂表面被还原生成CO2,铂起催化作用 | |
| C. | CO在催化剂表面可能和O2、NO反应 | |
| D. | NO、CO均能与人体中的血红蛋白结合 |
2.下列反应中,不属于四种基本反应类型的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2 | ||
| C. | CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2 | D. | Fe+2FeCl3═3FeCl2 |
3.向1L含0.1mol/LNaAlO2和0.2mol/LNaOH的溶液中缓缓通入二氧化碳,随n(CO2)增大,先后发生三个反应.已知酸性:H2CO3>HCO3->Al(OH)3.下列说法正确的是( )
| A. | n(CO2)=0.1时,c(Na+)>c(AlO2-)>c(CO32-)>c(OH-) | |
| B. | 0.1mol<n(CO2)<0.15时发生的反应是:Na2CO3+CO2+H2O═2NaHCO3 | |
| C. | n(CO2)=0.15时,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| D. | n(CO2)=0.3时,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |