题目内容
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 0.1mol•L-1NaHCO3溶液:H+、Al3+、Cl-、CH3COO- | |
| B. | 0.1mol•L-1CuCl2溶液:K+、NH4+、OH-、S2- | |
| C. | 0.1mol•L-1FeCl2溶液:Na+、NH4+、I-、SO42- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液:Fe3+、Na+、SO32ˉ、NO3- |
分析 A.与HCO3-反应的离子不能大量共存;
B.与Cu2+反应的离子不能大量共存;
C.离子之间不发生任何反应;
D.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液呈酸性.
解答 解:A.Al3+与HCO3-发生互促水解反应,且H+、CH3COO-反应生成弱酸,不能大量共存,故A错误;
B.S2-与Cu2+反应生成沉淀,NH4+、OH-反应生成一水合氨,不能大量共存,故B错误;
C.离子之间不发生任何反应,可大量共存,故C正确;
D.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液呈酸性,酸性条件下SO32-、NO3-发生氧化还原反应,故D错误.
故选C.
点评 本题考查离子的共存,为高考高频考点,侧重氧化还原反应的离子共存问题的考查,注意信息的抽取和应用,选项D为解答的难点,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.洗涤下列仪器时,选用的试剂(括号中的物质)不正确的是( )
| A. | 做过木炭还原氧化铜实验的硬质玻璃管(盐酸) | |
| B. | 长期存放氯化铁溶液的试剂瓶(稀硫酸) | |
| C. | 做过碘升华实验的试管(酒精) | |
| D. | 沾有油污的烧杯(纯碱溶液) |
4.用标准盐酸溶液滴定未知浓度的NaOH溶液,下列操作会引起实验结果偏小的是( )
| A. | 洗净酸式滴定管后,立即装入标准盐酸进行滴定 | |
| B. | 锥形瓶用待测NaOH溶液润洗后,再装入NaOH 溶液进行滴定 | |
| C. | 操作过程中,滴定前平视读数,滴定后仰视读数 | |
| D. | 用酚酞作指示剂滴至红色刚退去,停止滴沄,立即读数 |
14.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,c是否一定等于0.2否(选填“是”或“否”).
(2)单从乙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(3)丙组实验所得混合溶液中下列算式的精确结果:c(OH-)-c(HA)=10-9mol/L.
| 实验编号 | HA物质的量浓度/(mol•L-1) | NaOH物质的量浓度/(mol•L-1) | 混合溶液的pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
(2)单从乙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(3)丙组实验所得混合溶液中下列算式的精确结果:c(OH-)-c(HA)=10-9mol/L.
18.下列实验的操作或所用的试剂有错误的是( )
| A. | 实验室制取乙烯气体时,将温度计的水银球放入液面以下 | |
| B. | 可用酒精洗涤沾有苯酚的试管 | |
| C. | 证明分子CH2=CH-CHO既含有醛基又含有碳碳双键,可先向溶液中先加入足量的银氨溶液加热,充分反应后,再加入足量的溴水 | |
| D. | 苯中混有苯酚,加浓溴水,然后过滤 |
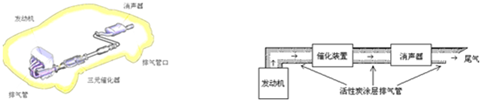
19. 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因HCO3-+H2O?H2CO3+OH-.
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液.
其pH由大到小的顺序是:dcab(填序号).
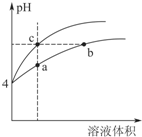
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线如图4,其中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是b=c>a;该醋酸溶液稀释过程中,下列
各量一定变小的是bd.
a.c(OH-) b. c(H+)
c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ d.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)以0.10mol•L-1NaOH为标准液,测定某盐酸的浓度.取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.12mol•L-1 mol•L-1
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol•L-1,c(OH-)=10-b mol•L-1,已知a+b=13,则:
①该温度下水的离子积常数Kw=10-13mol2•L-2.
②在该温度下,将100mL0.1mol•L-1的稀H2SO4与100mL0.4mol•L-1的NaOH溶液混合后,溶液的pH=12.
 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因HCO3-+H2O?H2CO3+OH-.
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液.
其pH由大到小的顺序是:dcab(填序号).
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线如图4,其中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是b=c>a;该醋酸溶液稀释过程中,下列
各量一定变小的是bd.
a.c(OH-) b. c(H+)
c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ d.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)以0.10mol•L-1NaOH为标准液,测定某盐酸的浓度.取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | 氢氧化钠溶液的浓度 (mol•L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 24.12 | 20.00 |
| 2 | 0.10 | 23.88 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.12mol•L-1 mol•L-1
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol•L-1,c(OH-)=10-b mol•L-1,已知a+b=13,则:
①该温度下水的离子积常数Kw=10-13mol2•L-2.
②在该温度下,将100mL0.1mol•L-1的稀H2SO4与100mL0.4mol•L-1的NaOH溶液混合后,溶液的pH=12.