题目内容
17.物质的量浓度为18.4mol/L的浓硫酸(密度为1.84g/cm3)100mL与一定量的铜共热得到二氧化硫气体体积为2.24升(标准状况).(假设反应后溶液的体积不变)(1)求浓硫酸的质量百分比浓度?
(2)求被还原的硫酸的物质的量?
(3)配制100毫升3.68mo1/L的稀硫酸需要上述浓硫酸多少毫升?
(4)在反应后的溶液加入足量的BaCl2溶液,可产生沉淀多少克?
分析 发生Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
(1)w=$\frac{m溶质}{m溶液}$×100%;
(2)由反应可知,n(H2SO4)还原=n(SO2);
(3)结合稀释前后溶质的物质的量不变计算;
(4)结合硫酸根离子守恒计算.
解答 解:发生Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
(1)w=$\frac{m溶质}{m溶液}$×100%=$\frac{0.1L×18.4mol/L×98g/mol}{0.1L×1.84g/mL×1{0}^{-3}L/mL}$×100%=98%,答:浓硫酸的质量百分比浓度为98%;
(2)由反应可知,n(H2SO4)还原=n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,答:被还原的硫酸的物质的量为0.1mol;
(3)由稀释前后溶质的物质的量不变可知,配制100毫升3.68mo1/L的稀硫酸需要上述浓硫酸为$\frac{0.1L×3.68mol/L}{18.4mol/L}$=0.02L=20mL,
答:需要上述浓硫酸20mL;
(4)由硫酸根离子守恒可知,沉淀硫酸的物质的量为n(H2SO4)-n(SO2)=1.84mol-0.1mol=1.74mol,沉淀的质量为1.74mol×233g/mol=405.42g,
答:沉淀质量为405.42g.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、物质的量基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
7.化学与生活、能源、环境等密切相关.下列描述错误的是( )
| A. | 采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体 | |
| B. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关 | |
| C. | 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| D. | 氮化硅陶瓷是一种新型无机非金属材料 |
5.某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
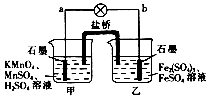

| A. | b电极上发生还原反应 | |
| B. | 甲烧杯中溶液的pH逐渐减小 | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | 外电路的电流方向是从a到b |
2.已知氯化铁溶液与碘化钾溶液混合时发生反应:2Fe3+(aq)+2I-(aq)=2Fe2+(aq)+I2(s).现将1 L 0.25mol•L-1氯化铁溶液与4 L 0.10 mol•L-碘化钾溶液混合后,在第2min时.测得混合溶液中c(I-)=0.04 mo1•L-.则下列说法正确的是( )
| A. | 第2min时,c(Fe2+)=0.01 mol•L-1 | |
| B. | 混合溶液中,c(K+)=0.01 mol•L-1 | |
| C. | 0~2min内,v(I-)=0.01 mol•L-1•min-1 | |
| D. | 第2min时,c(Fe3+)=0.01 mol•L-1 |
9.短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示,下列说法一定正确的是( )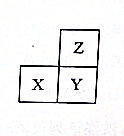

| A. | 最高正化合价:Z>X | |
| B. | X、Y、Z的单质中,Z的熔点最高 | |
| C. | 若X为非金属元素,则离子半径:Xn->Ym->Zm- | |
| D. | X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强 |
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1NaHCO3溶液:H+、Al3+、Cl-、CH3COO- | |
| B. | 0.1mol•L-1CuCl2溶液:K+、NH4+、OH-、S2- | |
| C. | 0.1mol•L-1FeCl2溶液:Na+、NH4+、I-、SO42- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液:Fe3+、Na+、SO32ˉ、NO3- |
10.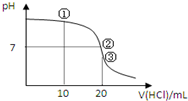 常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
 常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )| A. | ①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)>c(C1-)>c(OH-)=c(H+) | |
| C. | ③溶液:c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 滴定过程中可能出现:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
 .
.