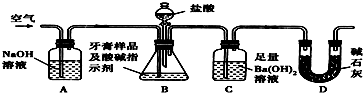
题目内容
13.关于原电池的叙述中正确的是( )| A. | 构成原电池的电极是两种不同的金属 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池负极发生的电极反应是还原反应 | |
| D. | 原电池的正极是还原剂,总是溶液中的阳离子在此被还原 |
分析 原电池是把化学能转变为电能的装置,原电池放电时,负极上失去电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流下正极,电极材料可由金属构成,也可由能导电的非金属和金属材料构成.
解答 解:A.原电池的电极可由两种不同的金属构成,也可由金属和能导电的非金属构成,故A错误;
B.原电池是把化学能转变为电能的装置,负极发生氧化反应失去电子,正极发生还原反应得到电子,电子由负极经外电路流向正极,故B正确;
C.负极发生氧化反应,故C错误;
D.正极发生还原反应,而不是正极为还原剂,故D错误.
故选B.
点评 本题考查原电池知识,侧重于原电池的组成、电极以及工作原理的考查,题目难度不大,注意相关基础知识的理解.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.25℃时,下列叙述正确的是( )
| A. | 将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| B. | NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO42-) | |
| C. | 0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合后pH<7,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | KNO3和CH3COONH4溶液pH均为7,两溶液中水的电离程度相同 |
8.某强氧化剂[XO(OH)2]+被亚硫酸钠还原到较低价态.若还原2.4×10-3 mol[XO(OH)2]+,需用30ml0.2mol/L的亚硫酸钠溶液,还原后X的最终化合价为( )
| A. | +2 | B. | +1 | C. | 0 | D. | -2 |
5.下列解释事实或实验现象的化学用语正确的是( )
| A. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 酸性KI淀粉溶液久置后变蓝 4I-+O2+2H2O═2I2+4OH- | |
| C. | 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH-═SiO32-+H2O | |
| D. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
2.双隔膜电解池的结构示意简图如图所示,利用铅蓄电池电解Na2SO4溶液可以制取H2SO4和NaOH,并得到H2和O2,.对该装置及其原理判断中,不正确的是( )

| A. | C1极电极与铅蓄电池的Pb电极相接,C2极与铅蓄电池的PbO2电极相接 | |
| B. | 当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重64g | |
| C. | A溶液为氢氧化钠溶液,B溶液为硫酸 | |
| D. | 该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑ |
3.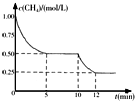 密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
 密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )| A. | 0~5 min内,v(H2)=0.1 mol/(L•min) | |
| B. | 10 min时改变的外界条件可能是升高温度 | |
| C. | 恒温下,缩小容器体积,平衡后c(H2)减小 | |
| D. | 12 min时反应达平衡的本质原因是气体总质量不再变化 |
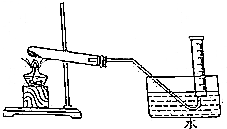 为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验: