题目内容
10.用双线桥表示下列反应中得失电子的情况,并按要求回答:3FeO+10HNO3═3Fe(NO3)3+NO↑+5H2O.
(1)氧化剂是HNO3;氧化产物是Fe(NO3)3.
(2)在参加反应的硝酸中,起氧化剂(被还原)作用的HNO3与起酸性作用的HNO3的质量比为1:9.
(3)用双线桥法标明电子转移的方向和数目.
(4)标况下生成11.2LNO时转移电子数为1.5NA个.
分析 (1)硝酸中N元素的化合价降低,FeO中Fe元素的化合价升高,被氧化;
(2)由N原子守恒可知,10molHNO3反应时1mol作氧化剂,9mol起酸性作用;
(3)由反应可知,3molFeO反应时转移电子3mol×(3-2)=3mol,以此来解答;
(4)3FeO+10HNO3═3Fe(NO3)3+NO↑+5H2O,生成1mol的一氧化氮转移3mol的电子,标况下生成11.2LNO物质的量为:$\frac{11.2}{22.4}$=0.5mol,所以转移电子数为1.5mol.
解答 解:(1)硝酸中N元素的化合价降低,则HNO3为氧化剂,FeO中Fe元素的化合价升高,被氧化,Fe(NO3)3为氧化产物,
故答案为:HNO3;Fe(NO3)3;
(2)由N原子守恒可知,10molHNO3反应时1mol作氧化剂,9mol起酸性作用,所以起氧化剂(被还原)作用的HNO3与起酸性作用的HNO3的质量比为1:9,
故答案为:1:9;
(3)由反应可知,3molFeO反应时转移电子3mol×(3-2)=3mol,则双线桥法表示电子转移的方向和数目为 ,
,
故答案为: ;
;
(4)3FeO+10HNO3═3Fe(NO3)3+NO↑+5H2O,生成1mol的一氧化氮转移3mol的电子,标况下生成11.2LNO物质的量为:$\frac{11.2}{22.4}$=0.5mol,所以转移电子数为1.5mol,则转移电子数为1.5NA,故答案为:1.5NA.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化及氧化还原反应中的基本概念即可解答,注意硝酸的作用为解答的易错点,题目难度不大.

练习册系列答案
相关题目
1.常温下,向20mL某浓度的硫酸溶液中滴入0.1mol•L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图,下列分析正确的是( )

| A. | V=40 | |
| B. | c点所示溶液中:c(H+)-c(OH-)=2c(NH3•H2O) | |
| C. | d点所示溶液中:c(NH4+)=2c(SO42-) | |
| D. | NH3•H2O的电离常数K=10-4mol•L-1 |
18.在以下电解槽中,随电解的进行,溶液的pH值会减小的是( )
| A. | 铜为阳极、铜为阴极,电解液为CuSO4溶液 | |
| B. | 石墨为阳极、铁为阴极,电解液为CuSO4溶液 | |
| C. | 铁为阳极,铜为阴极,电解液为AgNO3溶液 | |
| D. | 石墨为阳极,铁为阴极,电解液为NaCl溶液 |
2.下列说法正确的是( )
| A. | 目前使用的燃料液化石油气,其主要成分均属于烯烃 | |
| B. | 食用白糖的主要成分是蔗糖,小苏打的主要成分是碳酸钠 | |
| C. | 用碱式滴定管量取20.00mL0.1mol/LKMnO4溶液 | |
| D. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
19.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 工业上常用电解法制备元素C、D、E的单质 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 化合物AE与CE具有相同类型的化学键 | |
| D. | 元素A、B组成的化合物常温下一定呈气态 |
 ,AB2所含化学键的类型:离子键、非极性共价键(极性共价键、非极性共价键、离子键).
,AB2所含化学键的类型:离子键、非极性共价键(极性共价键、非极性共价键、离子键).
 HClO+H++Cl-.
HClO+H++Cl-.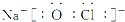 .
. .
.