题目内容
20.取100mL 18.3mol•L-1 的H2SO4与Zn反应,当Zn完全溶解时,生成的气体(可使品红褪色)在标准状况下的体积为22.4L.将所得的溶液稀释成1L,测得溶液H+的浓度为1mol•L-1,则所生成的气体中SO2与H2的体积比约为( )| A. | 1:2 | B. | 2:1 | C. | 1:4 | D. | 4:1 |
分析 锌与浓硫酸发生:Zn+2H2SO4=ZnSO4+SO2↑+H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4=ZnSO4+H2↑,生成气体为SO2和H2的混合物,物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,剩余硫酸的物质的量为:n(H2SO4)剩=$\frac{1}{2}$n(H+)=$\frac{1}{2}$×1L×1mol/L=0.5mol,消耗硫酸的物质的量为:n(H2SO4)消耗=0.1L×18.3mol/L-0.5mol=1.33mol,根据反应的化学方程式计算.
解答 解:100mL 18.3mol/L的H2SO4中含有硫酸的物质的量为:n(H2SO4)浓=0.1L×18.3mol/L=1.83mol,
剩余硫酸的物质的量为:n(H2SO4)剩=$\frac{1}{2}$n(H+)=$\frac{1}{2}$×1L×1mol/L=0.5mol,
消耗硫酸的物质的量为:n(H2SO4)消耗=1.83mol-0.5mol=1.33mol,
锌与浓硫酸发生:Zn+2H2SO4=ZnSO4+SO2↑+H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4=ZnSO4+H2↑,
生成气体为SO2和H2的混合物,物质的量为$\frac{22.4L}{22.4L/mol}$=1mol
设混合物气体中含有xmolSO2,ymolH2,
Zn+2H2SO4=ZnSO4+SO2↑+H2O
2xmol xmol
Zn+H2SO4=ZnSO4+H2↑
ymol ymol
则有:$\left\{\begin{array}{l}{x+y=1}\\{2x+y=1.33}\end{array}\right.$
解之得:$\left\{\begin{array}{l}{x=0.33}\\{y=0.67}\end{array}\right.$
所以n(SO2):n(H2)=x:y=0.33:67=1:2,
故选A.
点评 本题考查化学方程式的计算,题目难度中等,本题注意以下几点:①浓硫酸与锌反应生成SO2,②随着反应的进行,硫酸的浓度降低,与锌反应生成H2,③根据反应的方程式利用守恒的方法列式计算.

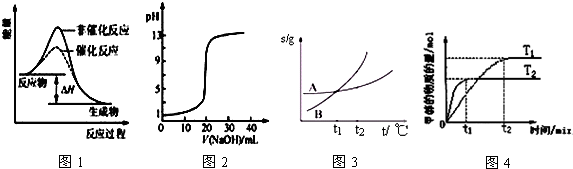
| A. | 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示0.1000 mol•L-1NaOH溶液滴定20.00mL0.1000 mol•L-1CH3COOH溶液所得到的滴定曲线 | |
| C. | 图3表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B=A | |
| D. | 图4表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应 |
| A. | 聚乙烯是无毒高分子化合物,可用作食品包装 | |
| B. | 在日常生活中,电化学腐蚀是造成钢铁腐蚀的主要原因 | |
| C. | 推广使用新能源,可以减少二氧化碳等温室气体的排放 | |
| D. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
| A. | 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2 | |
| B. | 等质量的O2与O3中,氧原子的个数比为3:2 | |
| C. | CaCl2及CaO2固体中阴、阳离子数之比均为2:1 | |
| D. | 10mL 0.3mol/LNaCl与30mL0.1mol/LAlCl3溶液中Cl-物质的量浓度比为1:3 |
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
| A. | 天津港爆炸案中对剧毒的氰化钠(NaCN) 喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| B. | 碳酸钙分解、氢氧化钡晶体和氯化铵固体反应、高温下铝与氧化铁反应都是吸热反应 | |
| C. | 玛瑙的主要成分是二氧化硅,陶瓷的主要成分是硅酸盐 | |
| D. | 豆浆制豆腐、纳米材料、塑料、橡胶及合成纤维等制造过程都会用到胶体的性质 |
| A. | 液氯 | B. | 漂白粉 | C. | 盐酸 | D. | 碘酒 |
①试管 ②烧杯 ③酒精灯 ④试管夹 ⑤石棉网 ⑥泥三角 ⑦坩埚 ⑧铁三角架.
| A. | ②③⑤⑧ | B. | ①④⑥ | C. | ①③⑤⑧ | D. | ②③⑤⑥ |