题目内容
14.现有某混合物的无色透明溶液,可能含有以下离子中的若干种:Na+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-.现取三份各100mL溶液进行如下实验:①第一份加入足量AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液充分加热后,收集到气体0.896L(标准状况);
③第三份加足量BaCl2溶液后,过滤后充分干燥得到沉淀6.27g,再经足量稀硝酸洗涤、干燥后,沉淀质量变为2.33g.根据上述实验现象和有关数据,回答下列问题:
(1)原溶液中一定存在的阴离子是CO32-、SO42-,一定不存在的离子是Mg2+、Ba2+,可能存在的离子是Cl-.
(2)②中发生化学反应的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(3)③中生成可溶于稀硝酸的沉淀化学式为BaCO3,物质的量为0.02mol.该沉淀溶于稀硝酸的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O.
分析 ①加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
②0.896L(标准状况)即0.04mol为氨气,溶液中一定含有NH4+,并且物质的量为0.04mol;
③2.33g为硫酸钡,6.27g为硫酸钡和碳酸钡;
再根据电荷守恒,得出一定存在钠离子.
解答 解:①与AgNO3溶液有沉淀产生的离子有Cl-、CO32-、SO42-;
②加足量NaOH溶液加热产生气体,气体是氨气,故一定有铵离子0.04mol;
③不溶于盐酸的2.33g为硫酸钡,物质的量是0.01mol;6.27g沉淀是硫酸钡和碳酸钡,碳酸钡质量为6.27g-2.33g=3.94g,物质的量为0.02mol,故一定存在CO32-、SO42-,因而一定没有 Mg2+、Ba2+;c(CO32-)=0.02÷0.1=0,0.2(mol/L),再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol;c(-)=2c(CO32-)+2x(SO42-)=0.06mol,故一定有Na+,至少0.02mol;
综合以上可以得出,一定存在的离子有NH4+、Na+、CO32-、SO42-,一定没有的离子Mg2+、Ba2+,可能存在Cl-;
(1)原溶液中一定存在的阴离子是CO32-、SO42-,一定不存在的离子是 Mg2+、Ba2+,可能存在的离子是Cl-;
故答案为:CO32-、SO42-,Mg2+、Ba2+,Cl-;
(2)②中发生化学反应的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(3)③中生成可溶于稀硝酸的沉淀化学式为BaCO3,物质的量为0.02mol,该沉淀溶于稀硝酸的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O.
点评 本题考查常见阴、阳离子的检验,涉及到用电荷守恒推断离子的存在,做题时需要细致分析,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
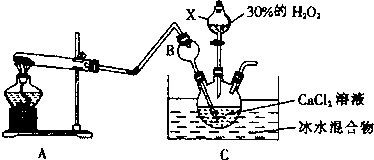
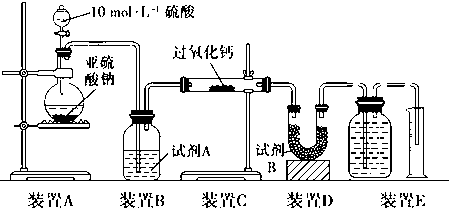
小学生10分钟应用题系列答案| A. |  蒸发FeCl3溶液得氯化铁晶体 | |
| B. |  测量氯气的体积 | |
| C. |  作为制取少量SO2的尾气吸收装置 | |
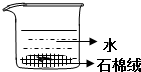
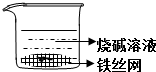
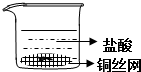
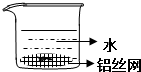
| D. | 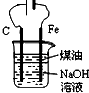 制备Fe(OH)2并能较长时间观察其颜色 |
| A. | ClO-作氧化剂 | |
| B. | FeO42-为还原产物 | |
| C. | 每产生1 mol FeO42-,转移3 mol电子 | |
| D. | OH-作氧化剂 |
| A. | 1.08mol•L-1 | B. | 1.37mol•L-1 | C. | 1.54mol•L-1 | D. | 2.48mol•L-1 |
| A. | 标准状况下,22.4L SO3中含有的分子数为NA个 | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2mol NO和1mol O2充分反应,产物的分子数为2NA |