题目内容
6.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂.
| A. | ①② | B. | ②⑤ | C. | ②④ | D. | ③⑤ |
分析 增大反应物的浓度和增大压强,只能增大活化分子数,不能增大活化分子百分数,能使反应物中活化分子数和活化分子百分数同时增大,可升高温度、加入催化剂等措施.
解答 解:增大反应物的浓度和增大压强,只能增大活化分子数,不能增大活化分子百分数,而②和⑤既能增大活化分子数,又能增大活化分子百分数,移去生成物,浓度降低,活化分子和活化分子的百分数都减小,
故选B.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度、压强、催化剂对反应速率影响的实质为解答的关键,侧重分析与应用能力的考查,注意活化理论的理解及应用,题目难度不大.

练习册系列答案
相关题目
16.下列离子在酸性溶液中能大量共存的是( )
| A. | Na+、K+、C1O-、I- | B. | C1-、NO3-、Fe2+、Na+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Fe3+、NH4+、Br-、NO3- |
1.含有a mol FeBr2的溶液中,通入x mol Cl2.下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
| A. | x=0.4a,2Fe2++Cl2═2Fe3++2Cl- | |
| B. | x=0.6a,2Br-+Cl2═Br2+2Cl- | |
| C. | x=2a,2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| D. | x=1.5a,2Fe2++4Br-+3Cl2═2Br2+2Fe3++6Cl- |
11.理论上,不能设计为原电池的化学反应是( )
| A. | 2H2(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2H2O(l)△H<0 | B. | 2FeCl3(aq)+Fe(s)═3FeCl2(aq)△H<0 | ||
| C. | CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(l)△H<0 | D. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H<0 |
18.已知离子氧化性Fe3+>Cu2+>Fe2+>Zn2+在溶有Fe2(SO4)3和CuSO4的溶液中加入锌粉,下列说法中不正确的是( )
| A. | 若锌粉有剩余,则不溶物中一定有铜,可能有铁 | |
| B. | 若锌粉有剩余,则溶液中的金属阳离子只有Zn2+ | |
| C. | 若锌粉无剩余,且溶液中尚存有Cu2+,则一定有Fe2+ | |
| D. | 若锌粉无剩余,且溶液中无Cu2+,则一定有Zn2+,一定无Fe3+,但不能确定有无Fe2+ |
7.W、X、Y、Z均为短周期主族元素,原子序数依次增大,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18.下列说法正确的是( )
| A. | 原子半径:W>X | B. | 氧化物的水化物的酸性:Y<Z | ||
| C. | 阴离子的还原性:W>Z | D. | X与Y不能存在于同一离子化合物中 |
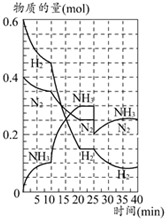 500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,分析图象完成下列问题:
500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,分析图象完成下列问题: