题目内容
15.下列有关NA的说法正确的是( )| A. | 标准状况下,22.4L SO3中含有的分子数为NA个 | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2mol NO和1mol O2充分反应,产物的分子数为2NA |
分析 A、标况下三氧化硫为固体;
B、亚硫酸为弱电解质,在溶液中部分电离;
C、过氧化钠和水反应时,氧元素由-1价变为0价;
D、NO和氧气反应后的产物NO2中存在平衡:2NO2?N2O4.
解答 解:A、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、亚硫酸为弱电解质,在溶液中部分电离,故溶液中的氢离子的个数小于2NA个,故B错误;
C、过氧化钠和水反应时,氧元素由-1价变为0价,故当生成0.1mol氧气时转移0.2NA个电子,故C正确;
D、NO和氧气反应后的产物NO2中存在平衡:2NO2?N2O4,导致分子个数减小,故产物分子个数小于2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
3.a在常温下为离子化合物,由X、Y两元素构成,在a中Xm+和Yn-的电子层结构相同.已知下列反应:(1)a+H2O$\stackrel{电解}{→}$H2+b+c (2)H2+c→d(气)(3)b+c→a+e+H2O(4)d+e→a+f,则a、e、f依次是( )
| A. | NaCl NaClO HCl | B. | KCl KClO HClO | ||
| C. | Na2S Na2SO3 H2SO3 | D. | K2S K2SO3 H2SO4 |
10.下列试剂不能鉴别CO2和SO2的是( )
| A. | 澄清石灰水 | B. | 品红溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 溴水 |
20.若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能大量共存的是( )
| A. | NH4+ NO3- CO32- Na+ | B. | Na+ Ba2+ Mg2+ HCO3- | ||
| C. | NO3- Ca2+ K+ Cl- | D. | NO3- K+[Al(OH)4]- H+ |
7.W、X、Y、Z均为短周期主族元素,原子序数依次增大,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18.下列说法正确的是( )
| A. | 原子半径:W>X | B. | 氧化物的水化物的酸性:Y<Z | ||
| C. | 阴离子的还原性:W>Z | D. | X与Y不能存在于同一离子化合物中 |
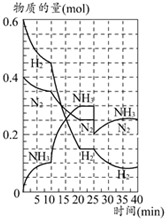 500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,分析图象完成下列问题:
500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,分析图象完成下列问题:
 化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数.
化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数.