题目内容
9.过氧化钙为白色晶体,难溶于水,常用于种子消毒、药物制造、鱼池增氧等.Ⅰ.某实验小组在实验室用钙盐制取CaO2•8H2O.
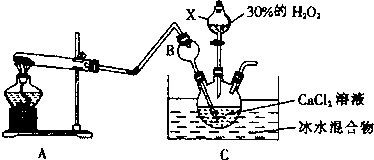
(1)A为实验室制取氨气的装置,则A中试管所装的试剂的名称为氯化铵和氢氧化钙.
(2)仪器B的作用是防倒吸.
(3)写出生成CaO2•8H2O的化学方程式CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O.
(4)制取CaO2•8H2O一般在低温下进行,原因是低于0℃,液体被冻结,反应困难,温度过高,过氧化氢分解速率加快,反应为放热反应,温度低有利于提高产率.
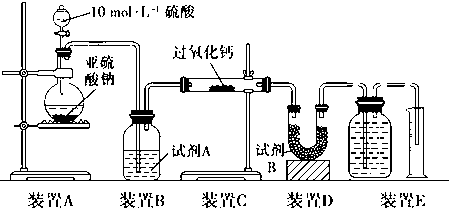
Ⅱ.该实验小组欲通过测量气体的体积来探究CaO2与SO2反应的特点,装置如图:(硬质玻璃管中为无水CaO2)
【提出假设】
假设1:只发生反应:2SO2+2CaO2=2CaSO3+O2,SO2未被氧化;
假设2:只发生反应:SO2+CaO2=CaSO4,SO2完全被氧化;
假设3:上述两个反应均发生,SO2部分被氧化.
【实验探究】
(5)该实验装置有一处明显错误,请用文字改正:装置E中广口瓶中的导气管应“短进长出”.
(6)试剂B为碱石灰,其作用是吸收未反应的SO2,防止装置E中的水蒸气进入硬质玻璃管与CaO2反应.
【实验数据处理】
实验测得装置C增重m g,装置E收集到的气体为V L(已换算成标准状况下).
(7)如果假设3成立,则V的取值范围是0<V<$\frac{7m}{30}$.
分析 Ⅰ.(1)实验室用加热固体氯化铵和氢氧化钙方法制取氨气;
(2)氨气极易溶于水,吸收氨气时应注意防止发生倒吸;
(3)结合题意和C装置中的反应物以及原子守恒可知,用CaCl2、H2O2、NH3可制得CaO2•8H2O,依据原子个数守恒书写方程式;
(4)制取CaO2•8H2O一般在0℃~5℃的低温下进行,低于0℃,液体被冻结,反应困难,温度过高,过氧化氢分解速率加快,反应为放热反应,低温有利于反应正向进行;
Ⅱ.(5)要用排液法测气体体积,则应短进长出;
(6)装置E为测定生成气体的体积,需要把剩余的二氧化硫除去,所以试剂B的作用是吸收未反应的SO2,防止装置E中的水蒸气进入硬质玻璃管与CaO2反应;
(7)如果假设3成立,则二氧化硫部分被氧化,则生成部分氧气,结合反应2SO2+2CaO2=2CaSO3+O2和SO2+CaO2=CaSO4可知,
若SO2未被氧化,发生反应方程式为:2CaO2+2SO2=2CaSO3+O2,依据差量法计算解答.
解答 解;Ⅰ.(1)实验室中用氯化铵和氢氧化钙固体制取氨气,方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,所以A中试管所装的试剂的名称为氯化铵和氢氧化钙,
故答案为:氯化铵和氢氧化钙;
(2)根据B的特点构造可以知道B是长颈漏斗,该装置可以防倒吸,结合氨气极易溶于水的性质,可知B作用为防止倒吸;
故答案为:防倒吸;
(3)结合题意和C装置中的反应物以及原子守恒可知,用CaCl2、H2O2、NH3可制得CaO2•8H2O,反应方程式为CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O,
故答案为:CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O;
(4)制取CaO2•8H2O一般在0℃~5℃的低温下进行,低于0℃,液体被冻结,反应困难,温度过高,过氧化氢分解速率加快,反应为放热反应,低温有利于反应正向进行;
故答案为:故答案为:低于0℃,液体被冻结,反应困难,温度过高,过氧化氢分解速率加快,反应为放热反应,温度低有利于提高产率;
Ⅱ.(5)装置E量气装置导气管长进短处,不能排液体测定气体体积,装置E中广口瓶中的导气管应“短进长出”;
故答案为:装置E中广口瓶中的导气管应“短进长出”;
(6)装置E为测定生成气体的体积,需要把剩余的二氧化硫除去,所以试剂B的作用是吸收未反应的SO2,防止装置E中的水蒸气进入硬质玻璃管与CaO2反应,
故答案为:吸收未反应的SO2,防止装置E中的水蒸气进入硬质玻璃管与CaO2反应;
(7)如果假设3成立,则二氧化硫部分被氧化,则生成部分氧气,结合反应2SO2+2CaO2=2CaSO3+O2和SO2+CaO2=CaSO4可知,
若SO2未被氧化,发生反应方程式为:2CaO2+2SO2=2CaSO3+O2,依据化学方程式和反应增重计算E中收集的氧气:
2CaO2+2SO2=2CaSO3+O2 固体增重
1mol 96g
$\frac{V}{22.4}$mol mg
1mol×mg=96g×$\frac{V}{22.4}$mol,
解得:V=$\frac{7m}{30}$,
所以当二氧化硫部分被氧化时,则生成的氧气体积范围为:0<V<$\frac{7m}{30}$,
故答案为:0<V<$\frac{7m}{30}$.
点评 本题考查了性质实验方案的设计方法及有关范围讨论化学计算,题目难度中等,明确题干信息及实验目的为解答此类题的关键,解答过程中实验设计的步骤和实验方案的确定需要根据题干要求分析,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

| A. | Al2(SO4)3、(NH4)2SO4 | B. | NaAlO2、NH4Cl | C. | Al2(SO4)3、NH4Cl | D. | AgNO3、(NH4)2SO4 |
| A. | 78gNa2O2固体含有的离子数为4NA | |
| B. | 22.4L乙烯中含有的分子数为NA | |
| C. | 用惰性电极电解NaCl溶液,每生成agNaOH时,电路中通过的电子个数为aNA | |
| D. | 1molSiO2晶体中Si-O键数为4NA |
| A. | 空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、液氨(电解质) | |
| B. | CO2(非电解质)、NH4Cl(铵盐)、HNO3(含氧酸)、NaOH(强电解质) | |
| C. | HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃) | |
| D. | NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯) |
| A. | x=0.4a,2Fe2++Cl2═2Fe3++2Cl- | |
| B. | x=0.6a,2Br-+Cl2═Br2+2Cl- | |
| C. | x=2a,2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| D. | x=1.5a,2Fe2++4Br-+3Cl2═2Br2+2Fe3++6Cl- |
| A. | 若锌粉有剩余,则不溶物中一定有铜,可能有铁 | |
| B. | 若锌粉有剩余,则溶液中的金属阳离子只有Zn2+ | |
| C. | 若锌粉无剩余,且溶液中尚存有Cu2+,则一定有Fe2+ | |
| D. | 若锌粉无剩余,且溶液中无Cu2+,则一定有Zn2+,一定无Fe3+,但不能确定有无Fe2+ |
| A. | 澄清石灰水 | B. | 品红溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 溴水 |