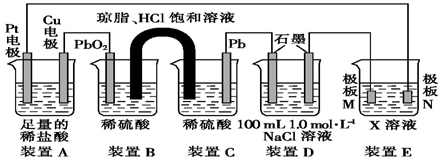
题目内容
17.完全中和一定量的H2SO4溶液用去NaOH 4g.若改用KOH中和,则需要KOH( )| A. | 0.2 mol | B. | 0.14mol | C. | 4g | D. | 5.6g |
分析 发生反应有:2NaOH+H2SO4=Na2SO4+2H2O、2KOH+H2SO4=K2SO4+2H2O,根据反应方程式可得关系式2KOH~H2SO4~2NaOH,根据关系式可计算出消耗氢氧化钾的质量.
解答 解:H2SO4与NaOH反应方程式为2NaOH+H2SO4=Na2SO4+2H2O,H2SO4与KOH反应方程式为:2KOH+H2SO4=K2SO4+2H2O,
根据反应方程式可得关系式:2KOH~H2SO4~2NaOH,
112 80
m(KOH) 4g
m(KOH)=$\frac{112×4g}{80}$=5.6g,n(KOH)=$\frac{5.6g}{56g/mol}$=0.1mol,
故选D.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握物质的量与其它物理量之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
14.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2L H2和D2的混合气体中所含的质子数为NA | |
| B. | 向足量水中通入1mol氯气,反应中转移的电子数为NA | |
| C. | 28g乙烯和丙烯的混合物中所含碳碳双键的数目为NA | |
| D. | 1L0.5mol•L-1Na2CO3溶液中阴离子的总数为0.5NA |
12.设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
| A. | 常温下,48gO3含有的氧原子数3NA | |
| B. | 33.6LCO中含有的原子数是3NA | |
| C. | 0.5mol•L-1CaCl2溶液中含Cl-数目为NA | |
| D. | 17gNH3所含的电子数为10NA |
2.在100mL 0.5mol/L AlCl3溶液中,加入100mL NaOH 溶液,得到2.34g 沉淀.则NaOH溶液物质的量浓度是(单位:mol/L)( )
| A. | 0.6 | B. | 0.9 | C. | 1.6 | D. | 1.7 |
9.将10mL充满NO2和O2混合气体的试管倒立在水槽中,反应停止后试管剩余2mL无色气体,原混合气体中NO2和O2各是多少毫升( )
| A. | 8.2mL和1.8mL | B. | 5.6mL和4.4mL | C. | 6.4mL和3.6mL | D. | 3.5mL和6.5mL |
6.已知25℃时有关弱酸的电离平衡常数如下.下列有关说法正确的是( )
| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 向冰醋酸中逐滴加水,醋酸的电离度和pH先增大后减小 | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 25℃时,在CH3COOH溶液与NaCN溶液中,水的电离程度前者大 | |
| D. | amol•L-1HCN溶液与bmol•L-1NaOH溶液等体积混合,所得溶液中c(Na+)<c(CN-),则b一定小于a |
7.已知W、X、Y、Z为短周期元素,原子序数依次增大.W、Z同主族,X、Y、Z同周期,其中只有X为金属元素.下列说法一定正确的是( )
| A. | 简单离子半径:W>X | |
| B. | 含氧酸的酸性:W>Z | |
| C. | 气态氢化物的稳定性:W<Y | |
| D. | 若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
 某化学创新实验小组设计如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃.
某化学创新实验小组设计如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃.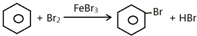 ;
;