题目内容
14.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 标准状况下,11.2L H2和D2的混合气体中所含的质子数为NA | |
| B. | 向足量水中通入1mol氯气,反应中转移的电子数为NA | |
| C. | 28g乙烯和丙烯的混合物中所含碳碳双键的数目为NA | |
| D. | 1L0.5mol•L-1Na2CO3溶液中阴离子的总数为0.5NA |
分析 A.H2和D2的质子数都为2,1mol混合气体质子数含2mol质子,气体摩尔体积标准状况下为22.4L/mol;
B.氯气和水反应是可逆反应不能进行彻底;
C.28g乙烯物质的量=$\frac{28g}{28g/mol}$=1mol,28g丙烯物质的量$\frac{28g}{42g/mol}$=0.67mol,则28g混合气体含双键数少于1mol;
D.碳酸钠溶液中碳酸根离子水解生成碳酸氢根离子和氢氧根离子,溶液中阴离子数增多.
解答 解:A.标准状况下,11.2L H2和D2的混合气体物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,所含的质子数为NA,故A正确;
B.氯气和水反应是可逆反应不能进行彻底,向足量水中通入1mol氯气,反应中转移的电子数小于NA ,故B错误;
C.若为28g乙烯物质的量=$\frac{28g}{28g/mol}$=1mol,含双键数为1mol,若为28g丙烯物质的量$\frac{28g}{42g/mol}$=0.67mol,双键数小于1mol,则28g乙烯和丙烯的混合物中含有双键数目小于NA,故C错误;
D.1L0.5mol•L-1Na2CO3溶液中碳酸钠物质的量=1L×0.5mol•L-1=0.5mol,碳酸根离子水解,CO32-+H2O?HCO3-+OH-,阴离子的总数大于0.5NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的应用,主要是离子数的计算应用、气体摩尔体积应用、氧化还原反应电子转移计算方法、盐类水解,题目难度中等,较好的考查学生分析解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列实验事实解释正确的是( )
| A. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定生成有色产物能溶于浓硝酸 | |
| B. | 在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 | |
| C. | 在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明含SO42- | |
| D. | 将铝片放入浓硫酸中,无明显实验现象,说明铝在冷的浓硫酸中不反应 |
2.下列各项中.两种物质在溶液中的反应可用同一离子方程式表示的是( )
| A. | 磷酸与烧碱、硝酸与澄淸石灰水 | |
| B. | 氯化钡与硫酸钠、硫酸与硝酸钡 | |
| C. | 碳酸铵与氢氧化钠、碳酸铵与石灰乳 | |
| D. | 纯碱与硫酸、碳酸氢钾与盐酸 |
9.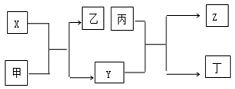 由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )
由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )
 由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )
由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )| A. | X为第三周期II族元素,Y和Z位于同一主族 | |
| B. | 甲、乙、丙均能与水发生化合反应 | |
| C. | 工业上常用电解乙制备X | |
| D. | X可用于制焰火烟花,Z可用作太阳能电池的材料 |
19.下列溶液中Cl-浓度最大的是( )
| A. | 800mL0.5mol/L的NaCl溶液 | B. | 100mL0.3mol/L的AlCl3溶液 | ||
| C. | 500mL0.3mol/L的CaCl2溶液 | D. | 300mL0.3mol/L的MgCl2溶液 |
17.完全中和一定量的H2SO4溶液用去NaOH 4g.若改用KOH中和,则需要KOH( )
| A. | 0.2 mol | B. | 0.14mol | C. | 4g | D. | 5.6g |

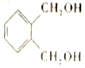 的符合下列条件的同分异构体有6 种(不考虑立体异构)
的符合下列条件的同分异构体有6 种(不考虑立体异构)