题目内容
2.在100mL 0.5mol/L AlCl3溶液中,加入100mL NaOH 溶液,得到2.34g 沉淀.则NaOH溶液物质的量浓度是(单位:mol/L)( )| A. | 0.6 | B. | 0.9 | C. | 1.6 | D. | 1.7 |
分析 100mL 0.5mol/L的AlCl3溶液中氯化铝的物质的量=0.1L×0.5mol/L=0.05mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.05mol×78g/mol=3.9g>2.34g,说明存在有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算NaOH溶液的物质的量的浓度.
解答 解:100mL 0.5mol/L的AlCl3溶液中氯化铝的物质的量=0.1L×0.5mol/L=0.05mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.05mol×78g/mol=3.9g>2.34g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
n[Al(OH)3]=$\frac{2.34g}{78g/mol}$=0.03mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.03mol×3=0.09mol,则c(NaOH)=$\frac{0.09mol}{0.1L}$=0.9mol/L;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.05mol 0.15mol 0.05mol
Al(OH)3 +OH-═AlO2-+2H2O
(0.05-0.03)mol (0.05-0.03)mol
则消耗的碱的物质的量为:0.15mol+(0.05-0.03)mol=0.17mol,则c(NaOH)=$\frac{0.17mol}{0.1L}$=1.7mol/L,
故选BD.
点评 本题考查方程式的有关计算,题目难度中等,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算,试题培养了学生的分析能力及化学计算能力.

| A. | 800mL0.5mol/L的NaCl溶液 | B. | 100mL0.3mol/L的AlCl3溶液 | ||
| C. | 500mL0.3mol/L的CaCl2溶液 | D. | 300mL0.3mol/L的MgCl2溶液 |
| A. | AgCl>AgI>AgBr | B. | AgCl>AgBr>AgI | C. | AgBr>AgCl>AgI | D. | AgBr>AgI>AgCl |
| A. | 1:1 | B. | 5:3 | C. | 33:11 | D. | 11:4 |
| A. | 0.2 mol | B. | 0.14mol | C. | 4g | D. | 5.6g |
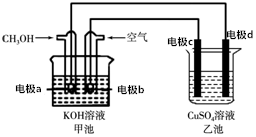 用该装置进行粗铜精炼,粗铜中一般含有锌、铁、银、金等杂质(此题中不考虑其他杂质)在如图所示的装置中,接通电路一段时间后,其中一个电极质量增加了3.2g,在此过程中,下列说法正确的是( )
用该装置进行粗铜精炼,粗铜中一般含有锌、铁、银、金等杂质(此题中不考虑其他杂质)在如图所示的装置中,接通电路一段时间后,其中一个电极质量增加了3.2g,在此过程中,下列说法正确的是( )| A. | 甲池化学能转化为电能,工作时OH-由a→b定向移动 | |
| B. | 通电时,整个电路中电流方向为b→c,d→a | |
| C. | 乙池中CuSO4溶液的浓度不变 | |
| D. | 电极d是纯铜,此过程中电子转移0.05mol |
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| C. | 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,还能沉降水中的悬浮物 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片和半导体器件的制造 |
| A. | Y与Z位于同一周期 | B. | 单质氧化性:Y<W | ||
| C. | W的氢化物具强还原性 | D. | lmol C中含有离子数目为2NA |