题目内容
18.NA表示阿伏加德罗常数的值,下列有关叙述正确的是( )| A. | 常温下,4.6gNO2和N2O4混合气体中所含原子总数为0.3NA | |
| B. | 4.2g乙烯和丙烯混合气体中含有的极性键数目为0.8NA | |
| C. | 常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同 | |
| D. | 1mol铁粉在1mol氯气中充分燃烧,转移的电子数为3NA |
分析 A、NO2和N2O4的最简式均为NO2;
B、乙烯和丙烯的最简式均为CH2;
C、溶液越稀,盐类水解程度越大;
D、1mol铁在1mol氯气中燃烧时,铁过量,根据氯气反应后变为-1价来分析.
解答 解:A、NO2和N2O4的最简式均为NO2,故4.6g混合物中含有的NO2的物质的量为0.1mol,故含0.3NA个原子,故A正确;
B、乙烯和丙烯的最简式均为CH2,故4.2g混合物中含有的CH2的物质的量为0.3mol,CH2中含两条极性共价键,故0.3molCH2则含极性共价键为0.6NA条,故B错误;
C、溶液越稀,盐类水解程度越大,故1L0.5mol/LNH4Cl溶液中铵根离子的水解程度小于2L0.25mol/LNH4Cl溶液中铵根离子的水解程度,故两溶液中铵根离子的个数不同,故C错误;
D、1mol铁在1mol氯气中燃烧时,铁过量,根据氯气反应后变为-1价可知,1mol氯气反应后转移2NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
6. 某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )
 某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )| A. | 电子流动方向为a→导线→b | |
| B. | H+经质子交换膜由右向左移动 | |
| C. | 放电一段是时间b极附近pH不变 | |
| D. | a 电极发生反应为:H2N(CH2)2NH2+16e-+4H2O═2CO2↑+N2↑+16H+ |
13.化学与生产、生活、社会发展等息息相关.下列说法正确的是( )
| A. | 为补充土壤中的钾元素,可在田间焚烧秸秆 | |
| B. | 煤经过气化、液化等物理变化可转变为清洁燃料 | |
| C. | 聚乙烯、聚氯乙烯均可作包装材料,且不会造成环境污染 | |
| D. | 在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质 |
3.下列物质的每步转化在给定条件下能一步实现且较合理的是( )
| A. | Cu2(OH)2CO3 $\stackrel{H_{2}SO_{4}}{→}$ CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| B. | 饱和食盐水$\stackrel{NH_{3}+CO_{2}}{→}$NaHCO3 $\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$ Mg(OH)2 $\stackrel{△}{→}$ MgO $\stackrel{电解}{→}$ Mg | |
| D. | NH3 $→_{催化剂,△}^{O_{2}}$ N2 $\stackrel{O_{2}+H_{2}O}{→}$HNO3 |
8.制备(NH4)2Fe(SO4)2•6H2O实验中,需对过滤出产品的母液(pH<1)进行处理.常温下,分別取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
| A. | 通人过量氯气:Fe2+、NH4+、H+、SO42-、Cl- | |
| B. | 加入少量 NaClO溶液:Fe2+、NH4+、SO42-、H+、ClO | |
| C. | 加入过量 NaOH 溶液:Na+、Fe2+、NH4+、SO42-、OH- | |
| D. | 加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- |
 燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.
燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.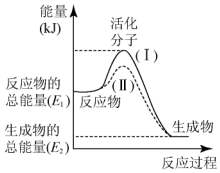 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:

 .
.