题目内容
9.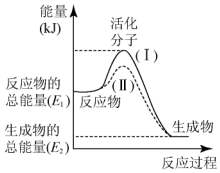 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:(1)图中所示反应是放热反应.(填“吸热”或“放热”)
(2)已知拆开1molH-H键、I-I键、H-I键分别需要吸收的能量为436kJ、151kJ、299kJ.则1molH2和1molI2完全反应生成HI时会放出(填“放出”或“吸收”)11kJ的热量.
分析 (1)由图可知,反应物的总能量大于生成物的总能量;
(2)焓变等于断裂化学键吸收的能量减去成键释放的能量,以此来解答.
解答 解:(1)由图可知,反应物的总能量大于生成物的总能量,则该反应为放热反应,故答案为:放热;
(2)发生H2+I2=2HI,旧键断裂吸收能量的值为436kJ+151kJ=587KJ,新键生成释放能量为299kJ×2=598KJ,旧键断裂吸收的能量小于新键生成释放的能量,△H=587KJ/mol-598KJ/mol=-11KJ/mol,反应为放热反应,放出的热量为598KJ-587KJ=11KJ,
故答案为:放出;11.
点评 本题考查反应热与焓变,为高频考点,把握图中能量变化、焓变与键能的关系为解答的关键,侧重分析与应用能力的考查,注意焓变的正负,题目难度不大.

练习册系列答案
相关题目
10.除去下列括号内杂质的试剂和方法正确的是( )
| A. | Fe3+(Al3+),加过量的氨水,过滤 | |
| B. | KCl溶液(BaCl2),加入足量K2SO4溶液,过滤 | |
| C. | CO2(SO2),饱和碳酸钠溶液,浓硫酸,洗气 | |
| D. | MgCl2溶液(Fe3+):加MgO固体,过滤 |
4.下列各选项所述的两个量,前者一定大于后者的是( )
| A. | Ag+、Cu2+与NH3形成配合物时的配位数 | |
| B. | NaCl的晶格能与MgO的晶格能 | |
| C. | H-F键的极性与H-O键的极性 | |
| D. | BF3的键角CS2的键角 |
14.有机物 在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )
在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )
 在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )
在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )| A. | 4 种 | B. | 5 种 | C. | 6 种 | D. | 7 种 |
1.25℃时,向盛有50mL pH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )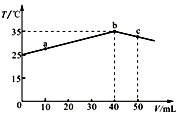

| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | c点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 |
18.NA表示阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 常温下,4.6gNO2和N2O4混合气体中所含原子总数为0.3NA | |
| B. | 4.2g乙烯和丙烯混合气体中含有的极性键数目为0.8NA | |
| C. | 常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同 | |
| D. | 1mol铁粉在1mol氯气中充分燃烧,转移的电子数为3NA |
19.下列晶体中熔点最高的是( )
| A. | 食盐 | B. | 硫磺 | C. | 金刚石 | D. | 钨 |
 立方烷是新合成的一种烃,其分子呈正立方体结构.如图所示:
立方烷是新合成的一种烃,其分子呈正立方体结构.如图所示: