题目内容
6. 某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )| A. | 电子流动方向为a→导线→b | |
| B. | H+经质子交换膜由右向左移动 | |
| C. | 放电一段是时间b极附近pH不变 | |
| D. | a 电极发生反应为:H2N(CH2)2NH2+16e-+4H2O═2CO2↑+N2↑+16H+ |
分析 H2N(CH2)NH2在负极a上失电子发生氧化反应,生成氮气、二氧化碳和水,电极反应式为H2N(CH2)NH2+4H2O-16e-═2CO2↑+N2↑+16H+,氧气在正极b上得电子发生还原反应,电极反应式为:O2+4e-+4H+=2H2O,电子由负极经导线流向正极,阳离子向正极移动,据此分析解答.
解答 解:A、根据以上分析,a是负极,b是正极,所以电子流动方向为a→导线→b,故A正确;
B、阳离子向正极移动,a是负极,b是正极,所以H+经质子交换膜由左向右移动,故B错误;
C、b的电极反应式为:O2+4e-+4H+=2H2O,所以溶液的pH值变大,而不是不变,故C错误;
D、H2N(CH2)NH2在负极M上失电子发生氧化反应,生成但其、二氧化碳和水,电极反应式为H2N(CH2)NH2+4H2O-16e-═2CO2↑+N2↑+16H+,故D错误;
故选A.
点评 本题考查了原电池原理,侧重于学生的分析,明确原电池正负极上得失电子、电解质溶液中阴阳离子移动方向即可解答,难度中等.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
16.下列实验方案的设计中,可行的是( )
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用萃取的方法分离煤油和汽油 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体的混合物 | |
| D. | 向某溶液中先加BaCl2溶液,若有白色沉淀,再加稀盐酸,沉淀不溶解,可检验其中含有SO${\;}_{4}^{2-}$ |
14.有机物 在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )
在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )
 在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )
在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )| A. | 4 种 | B. | 5 种 | C. | 6 种 | D. | 7 种 |
1.25℃时,向盛有50mL pH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )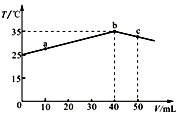

| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | c点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 |
18.NA表示阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 常温下,4.6gNO2和N2O4混合气体中所含原子总数为0.3NA | |
| B. | 4.2g乙烯和丙烯混合气体中含有的极性键数目为0.8NA | |
| C. | 常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同 | |
| D. | 1mol铁粉在1mol氯气中充分燃烧,转移的电子数为3NA |
15.25℃时,用浓度为0.1000mol/L的NaOH溶液分别滴定20.00mL浓度均为0.1000mol/L的两种酸HX、HY(忽略体积变化),实验数据如表,下列判断不正确的是( )
| 数据编号 | 滴入NaOH的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY | |
| B. | 由表中数据可估计出Ka(HX)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-) | |
| D. | 上述反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
16.茉莉酮可用作食用香精,其结构如图所示,下列关于其叙述正确的是( )
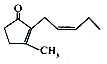

| A. | 茉莉酮易溶于水 | |
| B. | 茉莉酮中含有两种官能团 | |
| C. | 茉莉酮可与溴水、酸性KMnO4溶液发生加成反应,现象均为褪色 | |
| D. | 茉莉酮与二氢茉莉酮 互为同分异构体 互为同分异构体 |
 立方烷是新合成的一种烃,其分子呈正立方体结构.如图所示:
立方烷是新合成的一种烃,其分子呈正立方体结构.如图所示: