题目内容
10.能源是人类生存与发展比不可缺的,甲醇、甲醚(CH3OCH3)均是“清洁能源”,工业上可以通过多种方法合成它们.(1)以CO、H2为原料合成甲醚的过程中,在反应器中发生了下列反应:
a.CO(g)+2H2(g)?CH3OH(g)△H=-90KJ•mol-1
b.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23KJ•mol-1
c.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41KJ•mol-1
①选取适当的催化剂,在一定压强下,向某恒容密闭容器中通入H2和CO制备甲醚,测得的有关数据如图1所示.则制备甲醚时较适宜的生产温度范围是550K〜560K,通过理论分析得知反应c的存在能提高甲醚的产率,原因是反应c消耗了反应b中生成的水,有利于反应b向右进行.
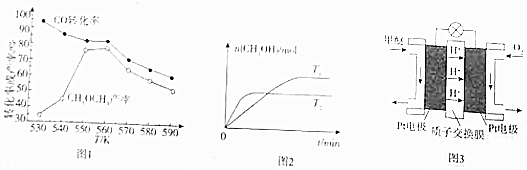
②3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H,则△H=-244kJ•mol-1.
(2)用下列反应也可得到甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g).已知TK时,该反应的化学平衡常数K=1.则在相同温度下,当一恒容密闭容器中c(CO2)=2.0×10-2mol•L-1、c(H2)=1.0×10-2mol•L-1、c(CH3OCH3)=1.0×10-4mol•L-1、c(H2O)=2.0×10-4mol•L-1时,v正< v逆(填“>”、“<”或“=”).
(3)控制适当的条件,CO2与H2也可转化为甲醇:CO2(g)+H2(g)?CH3OH(g)+H2O(g).将CO2、H2按物质的量比为1:3的比例加入到恒容密闭容器中反应.测得容器中n(CH3OH)在不同温度下随着时间的变化情况如图2所示.
①该反应的△H< 0(填“>”、“=”、“<”,下同)
②若温度T1对应的化学平衡常数K1=10,则温度T2对应的化学平衡常数K2< 10.
③下列数据能说明该反应一定处于平衡状态的是D (填选项字母).
A.气体密度保持不变 B.n(H2)=0.3mol
C.CO2、H2的消耗速率比为1:3 D.气体的平均相对分子质量保持不变
(4)图3为某绿色燃料电池的工作原理示意图,写出电池工作时负极上的电极反应式:CH3OCH3+3H2O-12e-=2CO2+12H+.
分析 (1)①图象中一氧化碳转化率最大是制备甲醚时较适宜的生产温度;反应c的存在能提高甲醚的产率是反应c消耗水促进反应b正向进行增大甲醚产量;
②依据热化学方程式和盖斯定律计算得到3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的焓变;
(2)2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g).计算此时浓度商Qc=$\frac{(1.0×1{0}^{-4})×(2.0×1{0}^{-4})^{3}}{(2.0{×}^{-2})^{2}(1.0×1{0}^{-2})^{6}}$和平衡常数比较判断进行方向;
(3)①先拐先平温度高,T2>T1,温度越高甲醇物质的量减小,平衡逆向进行,逆反应为吸热反应;
②反应为放热反应,升温平衡逆向进行,平衡常数减小;
③根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)装置图分析可知负极是甲醚在酸性溶液中失电子发生氧化反应生成二氧化碳,结合电荷守恒书写电极反应;
解答 (1)①图象中一氧化碳转化率最大是制备甲醚时较适宜的生产温度,在550 K〜560 K时一氧化碳转化率和甲醚产率最大,b.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23KJ•mol-1,c.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41KJ•mol-1,反应c消耗水促进反应b正向进行增大甲醚产量,
故答案为:550 K〜560 K;反应c消耗了反应b中生成的水,有利于反应b向右进行;
②a.CO(g)+2H2(g)?CH3OH(g)△H=-90KJ•mol-1
b.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23KJ•mol-1
c.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41KJ•mol-1
盖斯定律计算a×2+b+c得到热化学方程式:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-244 kJ•mol-1 ,
故答案为:-244 kJ•mol-1;
(2)2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g).计算此时浓度商Qc=$\frac{(1.0×1{0}^{-4})×(2.0×1{0}^{-4})^{3}}{(2.0{×}^{-2})^{2}(1.0×1{0}^{-2})^{6}}$=2>K=1,平衡逆向进行,v正<v逆 ,
故答案为:<;
(3)①先拐先平温度高,T2>T1,温度越高甲醇物质的量减小,平衡逆向进行,逆反应为吸热反应,正反应为放热反应,△H<0,
故答案为:<;
②若温度T1对应的化学平衡常数K1=10,反应为放热反应,升温平衡逆向进行,平衡常数减小,则温度T2对应的化学平衡常数K2 <10,
故答案为:<;,
③A.反应前后气体质量和体积不变,气体密度始终保持不变,不能说明反应达到平衡状态,故A错误;
B.n(H2)=0.3mol,不能证明正逆反应速率相同,故B错误;
C.反应速率之比等于化学反应速率之比为正反应速率之比,CO2、H2的消耗速率比为1:3,证明反应正向进行,不能说明反应达到平衡状态,故C错误;
D.反应前后气体质量不变,气体物质的量变化,气体的平均相对分子质量保持不变说明反应达到平衡状态,故D正确;
故答案为:D;
(4)装置图分析可知负极是甲醚在酸性溶液中失电子发生氧化反应生成二氧化碳,正极是氧气得到电子发生还原反应,负极电极反应为:CH3OCH3+3H2O-12e-=2CO2+12H+;
故答案为:CH3OCH3+3H2O-12e-=2CO2+12H+.
点评 本题考查了热化学方程式书写、化学平衡影响因素、图象的理解应用、平衡常数计算、原电池原理等,掌握基础是解题关键,题目难度中等.

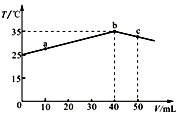
| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | c点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 |
| A. | 常温下,4.6gNO2和N2O4混合气体中所含原子总数为0.3NA | |
| B. | 4.2g乙烯和丙烯混合气体中含有的极性键数目为0.8NA | |
| C. | 常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同 | |
| D. | 1mol铁粉在1mol氯气中充分燃烧,转移的电子数为3NA |
| 数据编号 | 滴入NaOH的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY | |
| B. | 由表中数据可估计出Ka(HX)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-) | |
| D. | 上述反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
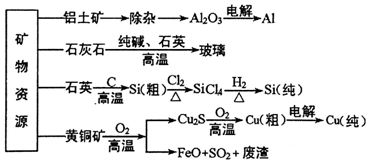
| A. | 在铝土矿制备较高纯度A1的过程中常用到NaOH溶液、CO2气体、冰晶石 | |
| B. | 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应 | |
| C. | 在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2:1 | |
| D. | 黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物 |
| A. | 食盐 | B. | 硫磺 | C. | 金刚石 | D. | 钨 |
| A. | 2FeCl3+Cu═2FeCl2+CuCl2 | B. | 2K+2H2O═2KOH+H2↑ | ||
| C. | NaOH+HCl═NaCl+H2O | D. | C(s)+H2O(g)═CO(g)+H2(g) |