题目内容
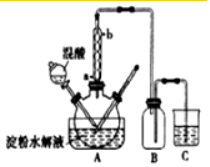
8. 燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.
燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.回答下列问题:
(1)该烃的相对分子质量是56,分子式是C4H8.
(2)若该烃为链状烃,写出所有同分异构体的结构简式(不考虑顺反异构)CH2=CHCH2CH3、CH3CH=CHCH3、CH3C(CH3)=CH2.
分析 甲装置增重3.6g为该有机物燃烧生成水的质量,则水的物质的量n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,n(H)=2n(H2O)=0.4mol,
乙装置中浓碱液增加的质量就是该有机化合物燃烧所产生的二氧化碳的质量,二氧化碳的物质的量为:n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(C)=n(CO2)=0.2mol,
C、H,原子个数比为12,又知该烃的蒸汽密度是同温同压下氢气密度的28倍,则M=28×2=56,设分子式为(CH2)x,则14x=56,解得x=4,以此来解答.
解答 解:甲装置增重3.6g为该有机物燃烧生成水的质量,则水的物质的量n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,n(H)=2n(H2O)=0.4mol,
乙装置中浓碱液增加的质量就是该有机化合物燃烧所产生的二氧化碳的质量,二氧化碳的物质的量为:n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(C)=n(CO2)=0.2mol,
C、H,原子个数比为12,又知该烃的蒸汽密度是同温同压下氢气密度的28倍,则M=28×2=56,设分子式为(CH2)x,则14x=56,解得x=4,
(1)该烃的相对分子质量是56,分子式是C4H8,故答案为:56;C4H8;
(2)若该烃为链状烃,所有同分异构体的结构简式(不考虑顺反异构)为CH2=CHCH2CH3、CH3CH=CHCH3、CH3C(CH3)=CH2,
故答案为:CH2=CHCH2CH3、CH3CH=CHCH3、CH3C(CH3)=CH2.
点评 本题考查有机物的分子式的计算,为高频考点,把握燃烧法确定分子式、原子守恒为解答的关键,侧重分析与计算能力的考查,注意烯烃的同分异构体书写,题目难度不大.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | Fe3+(Al3+),加过量的氨水,过滤 | |
| B. | KCl溶液(BaCl2),加入足量K2SO4溶液,过滤 | |
| C. | CO2(SO2),饱和碳酸钠溶液,浓硫酸,洗气 | |
| D. | MgCl2溶液(Fe3+):加MgO固体,过滤 |
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用萃取的方法分离煤油和汽油 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体的混合物 | |
| D. | 向某溶液中先加BaCl2溶液,若有白色沉淀,再加稀盐酸,沉淀不溶解,可检验其中含有SO${\;}_{4}^{2-}$ |
2CH4(g)?C2H4(g)+2H2(g) ②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:(Q1、Q2、Q3均为正值)
C(s)+2H2(g)?CH4 (g)△H=-Q1Ⅰ
C(s)+H2(g)═C2H2(g)△H=-Q2Ⅱ
C(s)+H2(g)═$\frac{1}{2}$C2H4(g)△H=-Q3Ⅲ
Q值大小比较正确的是( )
| A. | Q1>Q3>Q2 | B. | Q1>Q2>Q3 | C. | Q2>Q1>Q3 | D. | Q3>Q1>Q2 |
| A. | 硅原子和钠原子 | B. | 铜原子和氦原子 | C. | 碳原子和铝原子 | D. | 氧原子和碳原子 |
| A. | 常温下,4.6gNO2和N2O4混合气体中所含原子总数为0.3NA | |
| B. | 4.2g乙烯和丙烯混合气体中含有的极性键数目为0.8NA | |
| C. | 常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同 | |
| D. | 1mol铁粉在1mol氯气中充分燃烧,转移的电子数为3NA |
 立方烷是新合成的一种烃,其分子呈正立方体结构.如图所示:
立方烷是新合成的一种烃,其分子呈正立方体结构.如图所示: