题目内容
8.制备(NH4)2Fe(SO4)2•6H2O实验中,需对过滤出产品的母液(pH<1)进行处理.常温下,分別取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )| A. | 通人过量氯气:Fe2+、NH4+、H+、SO42-、Cl- | |
| B. | 加入少量 NaClO溶液:Fe2+、NH4+、SO42-、H+、ClO | |
| C. | 加入过量 NaOH 溶液:Na+、Fe2+、NH4+、SO42-、OH- | |
| D. | 加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- |
分析 A.氯气能够氧化亚铁离子;
B.次氯酸钠能够与亚铁离子、氢离子反应;
C.亚铁离子、铵根离子与氢氧根离子反应;
D.离子之间不反应,都不与(NH4)2•Fe(SO4)2•6H2O晶体中的离子反应.
解答 解:A.氯气与还原性离子Fe2+发生氧化还原反应,不能存在Fe2+离子,故A错误;
B.Fe2+有强还原性,酸性条件ClO-离子具有强氧化性,要发生氧化还原反应,不能共存,故B错误;
C.Fe2+、OH-结合生成沉淀,铵根离子与碱结合生成弱电解质,不能共存,故C错误;
D.该组离子之间不反应,加入过量NaClO溶液和NaOH的混合溶液,离子之间不反应,能共存,故D正确;
故选D.
点评 本题考查离子共存的应用,为高考的高频题,题目难度不大,明确发生反应的实质为解答关键,注意掌握离子反应发生条件,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
18.NA表示阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 常温下,4.6gNO2和N2O4混合气体中所含原子总数为0.3NA | |
| B. | 4.2g乙烯和丙烯混合气体中含有的极性键数目为0.8NA | |
| C. | 常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同 | |
| D. | 1mol铁粉在1mol氯气中充分燃烧,转移的电子数为3NA |
19.下列晶体中熔点最高的是( )
| A. | 食盐 | B. | 硫磺 | C. | 金刚石 | D. | 钨 |
16.茉莉酮可用作食用香精,其结构如图所示,下列关于其叙述正确的是( )
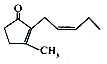

| A. | 茉莉酮易溶于水 | |
| B. | 茉莉酮中含有两种官能团 | |
| C. | 茉莉酮可与溴水、酸性KMnO4溶液发生加成反应,现象均为褪色 | |
| D. | 茉莉酮与二氢茉莉酮 互为同分异构体 互为同分异构体 |
3.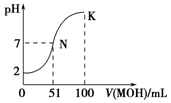 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | K点对应的溶液中:c(M+)+c(MOH)=c(A-) | |
| C. | K点对应的溶液中:c(MOH)+c(OH-)-c (H+)=0.005 mol•L-1 | |
| D. | N点水的电离程度小于K点水的电离程度 |
13.36.96L(标准状况)的H2、D2、O2的混合气体点燃正好完全反应,生成20g的H2O、D2O、HDO组成的水,原混合物中的O2的质量是( )
| A. | 16g | B. | 17.6g | C. | 17.8g | D. | 18g |
20.根据实际及反应本质判断,下列化学反应中能设计成原电池的是( )
| A. | 2FeCl3+Cu═2FeCl2+CuCl2 | B. | 2K+2H2O═2KOH+H2↑ | ||
| C. | NaOH+HCl═NaCl+H2O | D. | C(s)+H2O(g)═CO(g)+H2(g) |
16.对于可逆反应A(g)+3B(s)?C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
| A. | v(A)=2 mol•L-1•min-1 | B. | v(B)=1.2 mol•L-1•s-1 | ||
| C. | v(D)=0.4 mol•L-1•min-1 | D. | v(C)=0.1 mol•L-1•s-1 |