题目内容
13.化学与生产、生活、社会发展等息息相关.下列说法正确的是( )| A. | 为补充土壤中的钾元素,可在田间焚烧秸秆 | |
| B. | 煤经过气化、液化等物理变化可转变为清洁燃料 | |
| C. | 聚乙烯、聚氯乙烯均可作包装材料,且不会造成环境污染 | |
| D. | 在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质 |
分析 A.焚烧秸秆会污染大气;
B.煤的液化、气化属于化学变化;
C.塑料制品在自然界中难分解;
D.铁粉具有还原性,能消耗氧气.
解答 解:A.焚烧秸秆会产生大量烟尘和有害气体,会污染大气,不能在田间焚烧秸秆,故A错误;
B.煤的液化、气化是把煤炭转化为CO、氢气、甲醇等燃料,有新物质生成,属于化学变化,故B错误;
C.聚乙烯、聚氯乙烯等塑料制品在自然界中难分解,会造成环境污染,故C错误;
D.铁粉具有还原性,在食品包装时放入盛有铁粉的透气小袋,能消耗食品袋中的氧气,可防止食品氧化变质,故D正确.
故选D.
点评 本题考查了元素化合物知识,侧重考查相关物质的用途,明确相关物质的性质是解题关键,要求同学们在平时的学习中加强基础知识的储备,以便能够灵活应用.

练习册系列答案
相关题目
3.已知下列两个气态物质之间的反应:C2H2(g)+H2(g)?C2H4(g) ①
2CH4(g)?C2H4(g)+2H2(g) ②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:(Q1、Q2、Q3均为正值)
C(s)+2H2(g)?CH4 (g)△H=-Q1Ⅰ
C(s)+H2(g)═C2H2(g)△H=-Q2Ⅱ
C(s)+H2(g)═$\frac{1}{2}$C2H4(g)△H=-Q3Ⅲ
Q值大小比较正确的是( )
2CH4(g)?C2H4(g)+2H2(g) ②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:(Q1、Q2、Q3均为正值)
C(s)+2H2(g)?CH4 (g)△H=-Q1Ⅰ
C(s)+H2(g)═C2H2(g)△H=-Q2Ⅱ
C(s)+H2(g)═$\frac{1}{2}$C2H4(g)△H=-Q3Ⅲ
Q值大小比较正确的是( )
| A. | Q1>Q3>Q2 | B. | Q1>Q2>Q3 | C. | Q2>Q1>Q3 | D. | Q3>Q1>Q2 |
4.下列各选项所述的两个量,前者一定大于后者的是( )
| A. | Ag+、Cu2+与NH3形成配合物时的配位数 | |
| B. | NaCl的晶格能与MgO的晶格能 | |
| C. | H-F键的极性与H-O键的极性 | |
| D. | BF3的键角CS2的键角 |
1.25℃时,向盛有50mL pH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )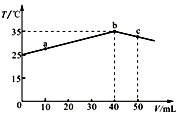

| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | c点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 |
8.人类生活、社会的可持续发展与化学密切相关,下列有关叙述正确的是( )
| A. | 高压钠灯能发出透雾能力强的淡紫色光,常用做路灯 | |
| B. | 用水清洗盛装过浓硫酸的铁捅要远离火源 | |
| C. | 理电池应用广泛,是因为锉能直接与水反应,不需要特殊的电解质溶液 | |
| D. | 据报导,一定条件下氢气可转变为金属氢,金属氢具备超导等优良性能.由氢气转变为金属氢属于同一元索的同位素之间的转化 |
18.NA表示阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 常温下,4.6gNO2和N2O4混合气体中所含原子总数为0.3NA | |
| B. | 4.2g乙烯和丙烯混合气体中含有的极性键数目为0.8NA | |
| C. | 常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同 | |
| D. | 1mol铁粉在1mol氯气中充分燃烧,转移的电子数为3NA |
2.工业上利用无机矿物资源生产部分材料的流程示意图如图.下列说法不正确的是( )

| A. | 在铝土矿制备较高纯度A1的过程中常用到NaOH溶液、CO2气体、冰晶石 | |
| B. | 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应 | |
| C. | 在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2:1 | |
| D. | 黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物 |
3.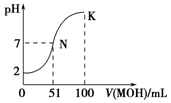 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | K点对应的溶液中:c(M+)+c(MOH)=c(A-) | |
| C. | K点对应的溶液中:c(MOH)+c(OH-)-c (H+)=0.005 mol•L-1 | |
| D. | N点水的电离程度小于K点水的电离程度 |
