题目内容
9.下列装置所示的实验中,能达到实验目的是( )| A. | 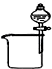 分离碘和酒精 | B. | 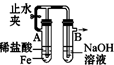 较长时间观察Fe (OH)2白色沉淀 | ||
| C. | 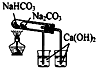 验证NaHCO3和Na2CO3的热稳定性 | D. | 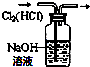 除去Cl2中HCl |
分析 A.碘溶于酒精;
B.利用Fe与盐酸反应生成的氢气排出空气,且利用氢气的压力使氯化亚铁与NaOH接触;
C.碳酸氢钠不稳定;
D.二者均与NaOH溶液反应.
解答 解:A.碘溶于酒精,应选蒸馏法,不能利用分液,故A错误;
B.利用Fe与盐酸反应生成的氢气排出空气,且利用氢气的压力使氯化亚铁与NaOH接触,则生成的氢氧化亚铁可保存时间长,故B正确;
C.碳酸氢钠不稳定,则图中小试管中应为碳酸氢钠,可体现对比性,故C错误;
D.二者均与NaOH溶液反应,试剂不合理,应选饱和碳酸氢钠溶液,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯方法、实验装置、物质的性质为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
19.钛合金被誉为二十一世纪的金属,具有广泛用途.下列是提炼金属属的反应之一:TiO2+2C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO 其中被氧化的元素是( )
| A. | C | B. | Ti | C. | Cl | D. | Ti和C |
20.下列离子方程式的书写正确的是( )
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | NaHC03溶液与盐酸反应:H++HCO3-═CO2↑+H2O | |
| C. | 稀H2S04与Ba(OH)2溶液反应:H++S042-+OH-+Ba2+═BaS04↓+H2O | |
| D. | 氧化镁与盐酸混合:Mg0+H+═Mg2++H20 |
17.下列有关粒子的叙述正确的是( )
| A. | 非金属元素可以形成阳离子 | |
| B. | 金属元素只能形成阳离子 | |
| C. | 分子式相同的物质化学性质相同 | |
| D. | 单原子阳离子,均具有2或8电子稳定结构 |
4.常温下,以下各组离子在指定环境中一定能大量共存的是( )
| A. | 在c(H+)=10-100.1 mol•L-1的溶液中:Al3+、NH4+、Cl-、NO3- | |
| B. | 澄清透明的溶液:Fe2+、Na+、SO42-、NO3- | |
| C. | 水电离出来的c(H+)=10-12 0.1 mol•L-1的溶液:K+、HCO3-、Cl-、ClO- | |
| D. | 能使蓝色石蕊试纸变为红色的溶液:K+、CO32-、Na+、S2- |
14.一定温度下,下列溶液的离子浓度关系式正确的是( )
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| C. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| D. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
18.25℃时,物质的量浓度均为0.01mol•L-1的HA和MOH溶液,pH分别为3和12,将两溶液等体积混合后,所得溶液的pH为( )
| A. | ≥7 | B. | 一定>7 | C. | ≤7 | D. | 可能=7 |