题目内容
17.下列有关粒子的叙述正确的是( )| A. | 非金属元素可以形成阳离子 | |
| B. | 金属元素只能形成阳离子 | |
| C. | 分子式相同的物质化学性质相同 | |
| D. | 单原子阳离子,均具有2或8电子稳定结构 |
分析 A、铵根离子是非金属元素形成的阳离子;
B、高锰酸根离子和偏铝酸根离子,都是金属元素;
C、同分异构体的分子式相同,但结构不同;
D、氢离子没有电子.
解答 解:A、铵根离子是非金属元素形成的阳离子,所以非金属元素可以形成阳离子,故A正确;
B、高锰酸根离子和偏铝酸根离子,都是金属元素,所以金属元素也能形成阴离子,故B错误;
C、同分异构体的分子式相同,但结构不同,化学性质不同,故C错误;
D、氢离子没有电子,所以不一定达2或8电子稳定结构,故D错误;
故选A.
点评 本题考查了粒子的性质、同分异构现象的判断,题目难度不大,注意掌握同分异构体分子式相同,结构不同,化学性质不同.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列离子方程式正确的是( )
| A. | 硫化钠水解:S2-+2H2O?H2S+2OH- | |
| B. | 硫氢化钠的水解:HS-+H2O?H3O++S2- | |
| C. | 不断加热煮沸氯化铁溶液:Fe3++3H2O?Fe(OH)3+3H+ | |
| D. | NH4Cl水解:NH4++H2O?NH3•H2O+H+ |
5.下列括号中的物质是除去杂质所需的药品,其中错误的是( )
| A. | NaCl溶液中有杂质Na2SO4(氯化钡) | B. | FeS04溶液中有杂质CuSO4(铁粉) | ||
| C. | 生石灰中混有少量石灰石(盐酸) | D. | BaCl2溶液中有少量MgCl2(氢氧化钡) |
12.现有几种元素的性质或原子结构如下表:
(1)元素X的一种同位素用来作原子量标准,这种同位素的符号是612C.
(2)画出T的原子结构示意图 .
.
(3)写出工业上制取单质Z的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.
(4)写出Z单质在水溶液中的化学反应方程式Cl2+H2O=HCl+HClO.
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
(2)画出T的原子结构示意图
 .
.(3)写出工业上制取单质Z的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.
(4)写出Z单质在水溶液中的化学反应方程式Cl2+H2O=HCl+HClO.
2.下列说法中错误的是( )
| A. | 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 | |
| B. | 氯气易液化,液氯可以保存在钢瓶中 | |
| C. | 氯水、氯气、液氯均能与硝酸银溶液反应产生白色沉淀 | |
| D. | 过量的铁在氯气中燃烧生成FeCl2 |
9.下列装置所示的实验中,能达到实验目的是( )
| A. | 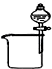 分离碘和酒精 | B. | 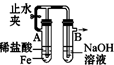 较长时间观察Fe (OH)2白色沉淀 | ||
| C. | 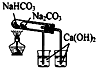 验证NaHCO3和Na2CO3的热稳定性 | D. | 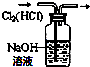 除去Cl2中HCl |
6.在含等物质的量浓度的Fe3+、NH4+、H+、Al3+溶液中,逐滴滴加氢氧化钠溶液,生成物依次产生的顺序是( )
| A. | Fe(OH)3、H2O、Al(OH)3、NH3•H2O、NaAlO2 | B. | Al(OH)3、NH3、H2O、Fe(OH)3、NaAlO2、H2O | ||
| C. | H2O、Fe(OH)3、Al(OH)3、NH3•H2O、NaAlO2 | D. | H2O、Fe(OH)3、Al(OH)3、NaAlO2、NH3•H2O |
 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷 C5H10.
C5H10.