题目内容
20.下列离子方程式的书写正确的是( )| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | NaHC03溶液与盐酸反应:H++HCO3-═CO2↑+H2O | |
| C. | 稀H2S04与Ba(OH)2溶液反应:H++S042-+OH-+Ba2+═BaS04↓+H2O | |
| D. | 氧化镁与盐酸混合:Mg0+H+═Mg2++H20 |
分析 A.反应生成硫酸亚铁和氢气;
B.反应生成氯化钠、水、二氧化碳;
C.不符合离子的配比;
D.电荷不守恒.
解答 解:A.铁和稀硫酸反应的离子反应为Fe+2H+═Fe2++H2↑,故A错误;
B.NaHC03溶液与盐酸反应的离子反应为H++HCO3-═CO2↑+H2O,故B正确;
C.稀H2S04与Ba(OH)2溶液反应的离子反应为2H++S042-+2OH-+Ba2+═BaS04↓+2H2O,故C错误;
D.氧化镁与盐酸混合的离子反应为Mg0+2H+═Mg2++H20,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
10.下列图示的四种实验操作名称从左到右依次是( )


| A. | 过滤、蒸发、蒸馏、萃取分液 | B. | 过滤、蒸馏、蒸发、萃取分液 | ||
| C. | 蒸发、蒸馏、过滤、萃取分液 | D. | 萃取分液、蒸馏、蒸发、过滤 |
11.下列物质间的转化,通过一步反应不能完成的是( )
| A. | FeCl3→FeCl2 | B. | NO2→HNO3 | C. | Al2O3→NaAlO2 | D. | SiO2→H2SiO3 |
15.某化合物由两种单质直接反应生成,将其加入足量Ba(OH)2溶液中有沉淀产生.下列物质符合上述条件的是( )
| A. | AlCl3 | B. | Na2O | C. | FeCl2 | D. | SO2 |
5.下列括号中的物质是除去杂质所需的药品,其中错误的是( )
| A. | NaCl溶液中有杂质Na2SO4(氯化钡) | B. | FeS04溶液中有杂质CuSO4(铁粉) | ||
| C. | 生石灰中混有少量石灰石(盐酸) | D. | BaCl2溶液中有少量MgCl2(氢氧化钡) |
12.现有几种元素的性质或原子结构如下表:
(1)元素X的一种同位素用来作原子量标准,这种同位素的符号是612C.
(2)画出T的原子结构示意图 .
.
(3)写出工业上制取单质Z的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.
(4)写出Z单质在水溶液中的化学反应方程式Cl2+H2O=HCl+HClO.
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
(2)画出T的原子结构示意图
 .
.(3)写出工业上制取单质Z的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.
(4)写出Z单质在水溶液中的化学反应方程式Cl2+H2O=HCl+HClO.
9.下列装置所示的实验中,能达到实验目的是( )
| A. | 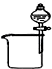 分离碘和酒精 | B. | 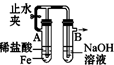 较长时间观察Fe (OH)2白色沉淀 | ||
| C. | 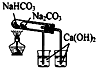 验证NaHCO3和Na2CO3的热稳定性 | D. | 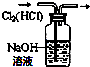 除去Cl2中HCl |
10.下列有关电解质的说法中正确的是( )
| A. | 液态HCl不导电,因此HCl是非电解质 | |
| B. | Na2O熔融态时能导电,所以Na2O是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | CO2水溶液能导电,所以CO2是电解质. |
 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷 C5H10.
C5H10.