题目内容
14.一定温度下,下列溶液的离子浓度关系式正确的是( )| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| C. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| D. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
分析 A.硫化氢是二元弱酸分步电离;
B.氨水溶液中一水合氨是弱碱存在电离平衡,稀释促进电离;
C.溶液中存在物料守恒,n(Na)=n(C2O42-);
D.对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液PH越大;当PH相同时,酸越强,盐的浓度越大;
解答 解:A.pH=5的H2S溶液中存在电离平衡,H2S?H++HS-,HS-?H++S2-,c(H+)=1×10-5 mol•L-1>c(HS-),故A错误;
B.氨水溶液中一水合氨是弱碱存在电离平衡,稀释促进电离pH=a的氨水溶液,稀释10倍后,其pH=b,则b>a+1,故B错误;
C.含等物质的量的NaHC2O4和Na2C2O4的溶液中存在物料守恒:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故C错误;
D.在相同的条件下测得①CH3COONa②NaHCO3 ③NaClO三种溶液pH相同,已知酸性:CH3COOH>HClO>HCO3-,所以水解程度:NaClO>NaHCO3>CH3COONa,pH相同时,溶液的浓度:NaClO<NaHCO3<CH3COONa,即c(Na+):①>②>③,故D正确;
故选D.
点评 本题考查了弱电解质电离平衡,盐类水解原理,电解质溶液中电荷守恒、物料守恒的分析,掌握原理和比较方法是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列括号中的物质是除去杂质所需的药品,其中错误的是( )
| A. | NaCl溶液中有杂质Na2SO4(氯化钡) | B. | FeS04溶液中有杂质CuSO4(铁粉) | ||
| C. | 生石灰中混有少量石灰石(盐酸) | D. | BaCl2溶液中有少量MgCl2(氢氧化钡) |
2.下列说法中错误的是( )
| A. | 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 | |
| B. | 氯气易液化,液氯可以保存在钢瓶中 | |
| C. | 氯水、氯气、液氯均能与硝酸银溶液反应产生白色沉淀 | |
| D. | 过量的铁在氯气中燃烧生成FeCl2 |
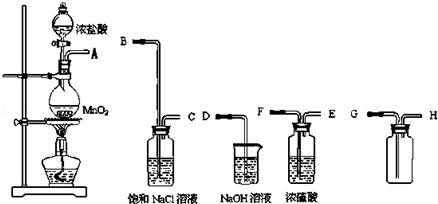
9.下列装置所示的实验中,能达到实验目的是( )
| A. | 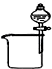 分离碘和酒精 | B. | 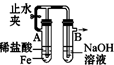 较长时间观察Fe (OH)2白色沉淀 | ||
| C. | 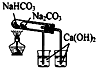 验证NaHCO3和Na2CO3的热稳定性 | D. |  除去Cl2中HCl |
6.在含等物质的量浓度的Fe3+、NH4+、H+、Al3+溶液中,逐滴滴加氢氧化钠溶液,生成物依次产生的顺序是( )
| A. | Fe(OH)3、H2O、Al(OH)3、NH3•H2O、NaAlO2 | B. | Al(OH)3、NH3、H2O、Fe(OH)3、NaAlO2、H2O | ||
| C. | H2O、Fe(OH)3、Al(OH)3、NH3•H2O、NaAlO2 | D. | H2O、Fe(OH)3、Al(OH)3、NaAlO2、NH3•H2O |
3.两种金属混合粉末15g,与足量的盐酸反应时生成11.2L氢气(标准状况),符合上述情况的金属混合物的是( )
| A. | Mg和Al | B. | Mg和Ag | C. | Na和Zn | D. | Fe和Zn |
17.下列元素在自然界中只以化合态存在的( )
| A. | O | B. | Cl | C. | N | D. | Fe |