题目内容
18.25℃时,物质的量浓度均为0.01mol•L-1的HA和MOH溶液,pH分别为3和12,将两溶液等体积混合后,所得溶液的pH为( )| A. | ≥7 | B. | 一定>7 | C. | ≤7 | D. | 可能=7 |
分析 25℃时,0.01mol/LHA溶液的pH=3,说明HA不完全电离,为弱电解质,0.01mol/L的MOH溶液的pH=12,说明碱完全电离,为强电解质,二者等体积混合恰好反应得到强碱弱酸盐.
解答 解:25℃时,0.01mol/LHA溶液的pH=3,说明HA不完全电离,为弱电解质,0.01mol/L的MOH溶液的pH=12,说明碱完全电离,MOH为强电解质,将物质的量浓度相等两溶液等体积混合恰好反应得到MA,AM属于强碱弱酸盐,溶液显碱性,溶液pH一定大于7,
故选B.
点评 本题考查溶液酸碱性定性分析,根据电解质浓度及溶液pH判断强弱电解质是解本题关键,再结合盐类水解进行分析,难度中等.

练习册系列答案
相关题目
9.下列装置所示的实验中,能达到实验目的是( )
| A. | 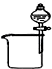 分离碘和酒精 | B. | 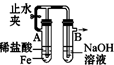 较长时间观察Fe (OH)2白色沉淀 | ||
| C. | 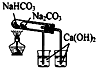 验证NaHCO3和Na2CO3的热稳定性 | D. | 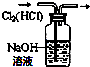 除去Cl2中HCl |
6.在含等物质的量浓度的Fe3+、NH4+、H+、Al3+溶液中,逐滴滴加氢氧化钠溶液,生成物依次产生的顺序是( )
| A. | Fe(OH)3、H2O、Al(OH)3、NH3•H2O、NaAlO2 | B. | Al(OH)3、NH3、H2O、Fe(OH)3、NaAlO2、H2O | ||
| C. | H2O、Fe(OH)3、Al(OH)3、NH3•H2O、NaAlO2 | D. | H2O、Fe(OH)3、Al(OH)3、NaAlO2、NH3•H2O |
13.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 盐酸 | B. | 氢氧化铁胶体 | C. | 氢氧化钠溶液 | D. | 氯化钠溶液 |
3.两种金属混合粉末15g,与足量的盐酸反应时生成11.2L氢气(标准状况),符合上述情况的金属混合物的是( )
| A. | Mg和Al | B. | Mg和Ag | C. | Na和Zn | D. | Fe和Zn |
10.下列有关电解质的说法中正确的是( )
| A. | 液态HCl不导电,因此HCl是非电解质 | |
| B. | Na2O熔融态时能导电,所以Na2O是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | CO2水溶液能导电,所以CO2是电解质. |
 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷 C5H10.
C5H10.

