题目内容
2. (1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为①=②>③;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈碱性,溶液中
c(Na+)>c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈酸性,溶液中c(Na+)<c(CH3COO-)(填“>”“=”或“<”);
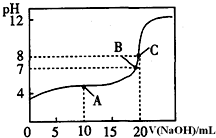
(4)25℃,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如右图.
①为减小实验误差,由图可知滴定时指示剂应选用酚酞 (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三点所示溶液导电能力最强的是C点对应的溶液;
③25℃,A点的离子浓度大小关系是c(A-)>c(Na+)>c(H+)>c(OH).
分析 (1)醋酸钠溶液中醋酸根离子水解,溶液显碱性,加水稀释促进水解,平衡正向进行,氢氧化钠为强碱溶液,醋酸钠为强碱弱酸盐,加热后氢氧化钠溶液的pH基本不变,而醋酸钠的水解程度增大,溶液pH增大;
(2)从两个角度考虑,一是相同pH的(NH4)2SO4与NH4Cl溶液的水解程度是否相等,二是NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制;
(3)等体积、等浓度的氢氧化钠与醋酸混合,恰好反应生成醋酸钠溶液,醋酸根离子水解溶液显碱性,钠离子浓度大于醋酸根离子,pH=13的氢氧化钠与pH=1的醋酸溶液中氢氧根离子浓度和氢离子浓度相同,等体积混合后醋酸又电离出氢离子,溶液显酸性醋酸根离子浓度大于钠离子浓度;
(4)由图两者恰好完全反应,溶液呈碱性,应选择碱性变色范围内的指示剂,离子浓度越大导电能力越强,根据曲线数据利用C(H+),结合HA?H++A-求出已电HA的浓度,再根据电离平衡常数表达式来解答.
解答 解:(1)pH=13的CH3COONa溶液加水稀释100倍后,由于醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11;
pH相等的NaOH溶液与CH3COONa溶液,醋酸钠为强碱弱酸盐,醋酸根离子水解溶液显示碱性,加热后醋酸根离子的水解程度增大,则溶液pH增大,所以分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH,
故答案为:>;醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11;>;
(2)相同pH的(NH4)2SO4与NH4Cl溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,则溶液中铵根离子浓度大小为:①=②>③,
故答案为:①=②>③;
(3)等体积、等浓度的氢氧化钠与醋酸混合,恰好反应生成醋酸钠溶液,溶液中的醋酸根离子水解溶液显碱性,钠离子浓度大于醋酸根离子,c(Na+)>c(CH3COO-),pH=13的氢氧化钠与pH=1的醋酸溶液中氢氧根离子浓度和氢离子浓度相同,等体积混合后醋酸又电离出氢离子,溶液显酸性,醋酸根离子浓度大于钠离子浓度,c(Na+)<c(CH3COO-),
故答案为:碱;>;酸;<;
(4)由图两者恰好完全反应,溶液呈碱性,应选择碱性变色范围内的指示剂是酚酞,C点是离子浓度最大导电能力最强,当加氢氧化钠的体积为0时,A点时,溶液中的溶质为等浓度的NaA和HA,溶液呈酸性,所以HA的电离程度大于A-的水解程度,所以溶液中离子浓度大小的关系为c(A-)>c(Na+)>c(H+)>c(OH),故答案为:①酚酞; ②C; ③c(A-)>c(Na+)>c(H+)>c(OH).
点评 本题考查了酸碱混合反应得到溶液酸碱性的分析判断,弱电解质电离、盐类水解的原理分析应用,掌握基础是解题关键,题目难度中等.

| A. | NO2 | B. | Ba(OH)2 | C. | Cl2 | D. | CH2COONa |
WO3 (s)+3H2 (g) $\stackrel{高温}{?}$W (s)+3H2O (g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应吸热(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2 (s)转变为WO2(g);
WO2 (s)+2H2 (g)═W (s)+2H2O (g);△H=+66.0kJ•mol-1
WO2 (g)+2H2(g)═W (s)+2H2O (g);△H=-137.9kJ•mol-1
则WO2 (s)═WO2 (g) 的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s)+2I2 (g)$?_{约3000℃}^{1400℃}$WI4 (g).下列说法正确的有ab.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
| A. | 92.37% | B. | 9.2% | C. | 50% | D. | 25% |
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | W1 | W3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=1.5mol•L-1•min-1 | |
| B. | 2c1<1.5 | |
| C. | 2ρ1=ρ2 | |
| D. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}(3{c}_{1}-1.5)^{3}}$ |
NO(g)+CO(g)═$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2kJ•mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
| A. | 加催化剂同时升高温度 | B. | 降低温度同时增大压强 | ||
| C. | 充入CO | D. | 加催化剂同时增大压强 |
①SiO2→Na2SiO3 ②Fe(OH)2-→Fe(OH)3 ③SiO2→H2SiO3
④Al2O3-→Al(OH)3 ⑤Na2O2→NaCl ⑥Al→NaAlO2( )
| A. | ①② | B. | ③④ | C. | ②③ | D. | ⑤⑥ |
(1)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)$\frac{\underline{催化剂}}{△}$4NO(g)+6H2O(g)△H=-905.8KJ/mol.
(2)氨气、空气可以构成燃料电池,其电池反应原理为4NH3+3O2═2N2+6H2O.则原电解质溶液显碱性(填“酸性”、“中性”或“碱性”),负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温度/°C | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号);
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400°C时,测得氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(4)①25°C时,将amol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$;
②向25mL0.10mol•L-1的盐酸中滴加氨水至过量,该过程中离子浓度大小关系一定不正确的是d (填字母序号).
a.c(Cl-)>c(H+)>c(NH4+)>c(OH-) b.c(C1-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
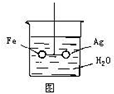 如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.
如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.