题目内容
2.已知氢化钾(KH)属于离子化合物,KH跟水反应可以放出氢气.下列说法中正确的是( )| A. | KH的水溶液呈碱性 | B. | KH中氢离子可以被还原为氢气 | ||
| C. | KH是一种强氧化剂 | D. | KH中的氢离子是裸露的质子 |
分析 由信息可知,发生KH+H2O=KOH+H2↑,KH中H元素的化合价升高,水中H元素的化合价降低,以此来解答.
解答 解:A.发生KH+H2O=KOH+H2↑,KOH溶液显碱性,故A正确;
B.KH中氢离子为-1价,化合价升高,被氧化成氢气,故B错误;
C.KH中H失去电子,则KH做还原剂,故C错误;
D.KH中的氢离子核外有2个电子,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、基本概念为解答的关键,侧重分析与应用能力的考查,注意结合信息判断发生的反应,题目难度不大.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 一氯代物只有一种的烷烃只能是甲烷 | |
| B. | 二氯甲烷无同分异构体,说明甲烷分子是正四面体结构 | |
| C. | 组成上相差一个或多个CH2的有机物一定互为同系物 | |
| D. | 能使酸性高能酸钾溶液褪色的烃一定含有C=C或C≡C |
10.火箭推进器常以联氨(N2H4) 为燃料、过氧化氢为助燃剂.已知下列各物质反应的热化学方程式:
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H1=-533.23kJ•mol-1
H2O(g)=H2O (l)△H2=-44kJ•mol-1
2H2O2(l)=2H2O(l)+O2(g)△H3=-196.4kJ•mol-1
则联氨与过氧化氢反应的热化学方程式可表示为( )
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H1=-533.23kJ•mol-1
H2O(g)=H2O (l)△H2=-44kJ•mol-1
2H2O2(l)=2H2O(l)+O2(g)△H3=-196.4kJ•mol-1
则联氨与过氧化氢反应的热化学方程式可表示为( )
| A. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=+817.63 kJ•mol-1 | |
| B. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ•mol-1 | |
| C. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=-641.63 kJ•mol-1 | |
| D. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-817.63 kJ•mol-1 |
17.在水溶液中能大量共存的一组离子是( )
| A. | Fe3+、NH4+、HCO3-、SO42- | B. | H+、Fe2+、ClO-、Cl- | ||
| C. | Mg2+、Na+、SO42-、NO3- | D. | Al3+、Ag+、OH-、Br- |
7.有一种阳离子与两种酸根离子组成的盐,称为混盐.混盐CaOCl2在酸性条件下,可产生Cl2.则下列有关混盐CaOCl2的判断正确的是( )
| A. | 该混盐具有和漂白粉相似的化学性质 | |
| B. | 该混盐的水溶液呈中性 | |
| C. | 该混盐与硫酸反应生成1摩尔氯气时,转移了1摩尔电子 | |
| D. | 该混盐中氯元素的化合价为零 |
11.下列有关材料的说法不正确的是( )
| A. | 制造普通水泥和玻璃的主要原料都用到石灰石 | |
| B. | 工业上制玻璃不会有温室气体的排放 | |
| C. | 玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料 | |
| D. | “中国”的英文单词叫China,这是由于中国制造的某种物质驰名世界,这种物质是陶瓷 |
12.下列各组离子在溶液中能够大量共存的是( )
| A. | NH4+、NO3-、Na+、SO42- | B. | H+、Fe2+、Na+、NO3- | ||
| C. | Ba2+、K+、Al3+、HCO3- | D. | NH4+、Li+、OH-、SO42- |
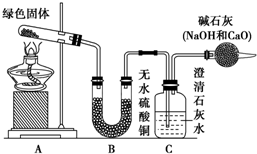 铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.
铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.