题目内容
4.下列说法错误的是( )| A. | 金属甲比金属乙容易失去电子,则甲比乙金属性强 | |
| B. | NaHCO3与NaOH反应有CO2生成 | |
| C. | 稀硝酸能将亚铁离子氧化为铁离子 | |
| D. | Na2CO3不能用于治疗胃酸过多 |
分析 A.金属越易失去电子,金属性越强;
B、NaHCO3与NaOH反应生成碳酸钠;
C、硝酸具有强氧化性;
D、Na2CO3不能用于治疗胃酸过多.
解答 解:A.元素的金属性强弱与失电子难以有关,越易失去电子,金属性越强,故A正确;
B、NaHCO3与NaOH反应生成碳酸钠,无二氧化碳气体产生,故B错误;
C、硝酸具有强氧化性,将亚铁离子氧化为铁离子,故C正确;
D、Na2CO3不能用于治疗胃酸过多,故D错误;
故选B.
点评 本题考查碳酸钠与碳酸氢钠的性质,涉及等浓度溶液碱性强弱,学习时注意基础知识的对比记忆.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
18.下列叙述正确的是( )
| A. | 同温同压下,相同体积的物质,它们的物质的量一定相等 | |
| B. | 任何条件下,等物质的量的二氧化硫和一氧化碳所含的分子数一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 等体积、等物质的量浓度的强酸中所含的H+数一定相等 |
19.有关钴和铁化合物的性质见下表.用含钴废料(含少量铁)可制备氯化钴:Co+2HCl═CoCl2+H2↑,工艺流程如下,试回答:
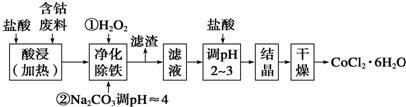
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为O2+4e-+2H2O=4OH-.
(2)生铁中含有一种铁碳化合物X(Fe3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,Y可溶于过量盐酸,形成黄绿色的溶液,写出Y与盐酸反应的化学方程式Fe3O4+8HCl=2FeCl3+FeCl2+4H2O.
(3)“净化除铁”中,写出加入H2O2时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)滤液的主要成分是CoCl2、NaCl、HCl.
(5)②步中用Na2CO3调pH≈4的原因是碳酸钠可与盐酸反应,降低溶液的酸性,增大pH,使铁离子沉淀完全.

| 物质 | 溶度积Ksp | 沉淀完全时的pH |
| Co(OH)2 | 5.9×10-15 | 9.4 |
| Fe(OH)2 | 1.6×10-14 | 9.6 |
| Fe(OH)3 | 1.1×10-36 | 3.7 |
(2)生铁中含有一种铁碳化合物X(Fe3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,Y可溶于过量盐酸,形成黄绿色的溶液,写出Y与盐酸反应的化学方程式Fe3O4+8HCl=2FeCl3+FeCl2+4H2O.
(3)“净化除铁”中,写出加入H2O2时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)滤液的主要成分是CoCl2、NaCl、HCl.
(5)②步中用Na2CO3调pH≈4的原因是碳酸钠可与盐酸反应,降低溶液的酸性,增大pH,使铁离子沉淀完全.
16.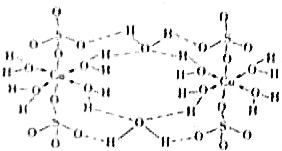 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A. | 在如图结构示意图中,所有氧原子都采用sp3杂化 | |
| B. | 在如图结构示意图中,存在配位键、共价键和离子键 | |
| C. | 胆矾是分子晶体,分子间存在氢键 | |
| D. | 胆矾中的水在不同温度下会分步失去 |
3.在一定温度下,对可逆反应A(g)+3B(g)?3C(g)的下列叙述中,能说明反应已达到平衡的是( )
| A. | C生成的速率与C分解的速率相等 | |
| B. | 单位时间内消耗amolA和同时生成3amolC | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的总物质的量不再变化 |
16.室温下,下列粒子一定能大量共存的是( )
| A. | 使酚酞变红色的溶液:Na+、Fe3+、SO42-、Cl- | |
| B. | 饱和氯水:K+、Na+、Cl-、HSO3- | |
| C. | pH=13溶液:Na+、K+、SiO32-、Cl- | |
| D. | 1.0mol/L KNO3溶液:H+、Fe2+、Cl-、SO32- |
14.50mL的酸式滴定管中,某浓度HCl溶液在30mL处,则该HCl溶液的体积为( )
| A. | 大于30mL | B. | 等于30mL | C. | 大于20mL | D. | 等于20mL |
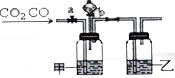 某学生用如图装置进行CO和CO2混合气体的分离和干燥.其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否).
某学生用如图装置进行CO和CO2混合气体的分离和干燥.其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否).