题目内容
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 17g羟基与17g NH3所含电子数均为10NA | |
| B. | lmolCl2溶于水转移电子数为NA | |
| C. | 1L0.1mol•L-1 NH4 HC03溶液中所含NH4+数为0.1NA | |
| D. | 标准状况下,11.2LN2和02混合气体中所含分子数为0.5NA |
分析 A.17g羟基的物质的量为1mol,含有9mol电子;
B.氯气与水反应是可逆反应;
C.铵根易水解;
D.标准状况下,11.2L混合气体的物质的量为0.5mol.
解答 解:A.17g羟基的物质的量为1mol,含有9mol电子,所含电子数为9NA,故A错误;
B.氯气与水反应是可逆反应,不能进行到底,转移电子数小于NA,故B错误;
C.铵根易水解,所含NH4+数小于0.1NA,故C错误;
D.标准状况下,11.2L混合气体的物质的量为0.5mol,所含分子数为0.5NA,故D正确.
故选D.
点评 本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11. 在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )
在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )
 在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )
在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )| A. | “彩雾”是一种混合物 | |
| B. | 上述过程中有物理变化 | |
| C. | 燃料燃烧产生的热量促使拉烟剂气化 | |
| D. | “彩雾”的形成与焰色反应的原理相同 |
12.氧化性最弱的微粒是( )
| A. | Cl2 | B. | Na+ | C. | Cu2+ | D. | Mg2+ |
9.下列关于0.01mol•L-1(NH4)2Fe(SO4)2溶液的说法正确的是( )
| A. | 25℃时,加水稀释后,n(H+)•n(OH-)的乘积不变 | |
| B. | 离子浓度关系:3c(Fe3+)+c(NH4+)+c(H+)=c(OH-)+2c(SO42-) | |
| C. | 溶液呈酸性是因为NH4++H2O?NH3H2O+H+ | |
| D. | 温度升高(假设溶液的体积没有变化)溶液的pH增大 |
16.同温同压下,等体积的两容器内分别充满由12C、14N、18O三种原子构成的一氧化二氮和二氧化碳,两容器中含有的( )
| A. | 分子数和气体质量均不同 | B. | 分子数和中子数均相同 | ||
| C. | 质子数和中子数均相同 | D. | 分子数、原子数和质子数均相同 |
7.在硫酸铝、硫酸钾和明矾的混合溶液中,SO42-的浓度为0.4mol/L,当加入等体积0.3mol/L KOH溶液时,生成的沉淀量最多.则反应后溶液中K+的浓度约为( )
| A. | 0.25mol/L | B. | 0.44mol/L | C. | 0.5mol/L | D. | 0.8mol/L |
14.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能大于O原子 | N原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为120° |
| C | H2O的沸点大于H2S的沸点 | H2O是液态的,H2S是气态的 |
| D | HF比HCl稳定 | HF分子间可以形成氢键 |
| A. | A | B. | B | C. | C | D. | D |
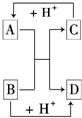 已知A、B、C、D是中学化学中常见的四种不同粒子.它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同粒子.它们之间存在如图所示的转化关系.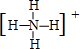 ,D的电子式
,D的电子式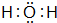 .
.