题目内容
7.在硫酸铝、硫酸钾和明矾的混合溶液中,SO42-的浓度为0.4mol/L,当加入等体积0.3mol/L KOH溶液时,生成的沉淀量最多.则反应后溶液中K+的浓度约为( )| A. | 0.25mol/L | B. | 0.44mol/L | C. | 0.5mol/L | D. | 0.8mol/L |
分析 当加入等体积、某浓度的KOH溶液时,恰好沉淀完全,反应后溶液中的溶质为K2SO4,结合体积变化及原子守恒计算.
解答 解:当加入等体积、0.3mol/L KOH溶液时,恰好沉淀完全,反应后溶液中的溶质为K2SO4,
设原溶液体积为V,则混合后溶液体积为2V,
n(K+)=2n(K2SO4)=2n(SO42-),
所以所得溶液中K+的物质的量浓度是:$\frac{2×0.4mol/L×VL}{2L}$=0.8mol/L,
故选D.
点评 本题考查物质的量浓度的计算,题目难度不大,根据质量守恒和电荷守恒的角度解答是解题的关键,注意熟练掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
14.下列实验操作和结论错误的是( )
| A. | 用新制Cu(OH)2可鉴别麦芽糖和蔗糖 | |
| B. | 用银镜反应可证明淀粉是否转化为葡萄糖,但不能证明是否完全转化 | |
| C. | 浓H2SO4可使蔗糖脱水变黑,证明蔗糖含C,H,O三种元素 | |
| D. | 蔗糖溶液中滴加几滴稀H2SO4后,水溶加热几分钟,加入到银氨溶液中,不能发生银镜反应,证明蔗糖不水解 |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 17g羟基与17g NH3所含电子数均为10NA | |
| B. | lmolCl2溶于水转移电子数为NA | |
| C. | 1L0.1mol•L-1 NH4 HC03溶液中所含NH4+数为0.1NA | |
| D. | 标准状况下,11.2LN2和02混合气体中所含分子数为0.5NA |
17.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)这些元素中,化学性质最不活泼的是Ar(填元素符号,下同).
(2)最高价氧化物的水化物中,酸性最强的化合物的化学式:HClO4,碱性最强的化合物的电子式: .
.
(3)最高价氧化物是两性氧化物的元素是Al.
(4)用电子式表示元素④与⑥形成化合物的过程: .
.
(5)①与⑦形成的化合物的电子式: ,该化合物是由极性(填“极性”或“非极性”)共价键形成的.
,该化合物是由极性(填“极性”或“非极性”)共价键形成的.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)最高价氧化物的水化物中,酸性最强的化合物的化学式:HClO4,碱性最强的化合物的电子式:
 .
.(3)最高价氧化物是两性氧化物的元素是Al.
(4)用电子式表示元素④与⑥形成化合物的过程:
 .
.(5)①与⑦形成的化合物的电子式:
 ,该化合物是由极性(填“极性”或“非极性”)共价键形成的.
,该化合物是由极性(填“极性”或“非极性”)共价键形成的. 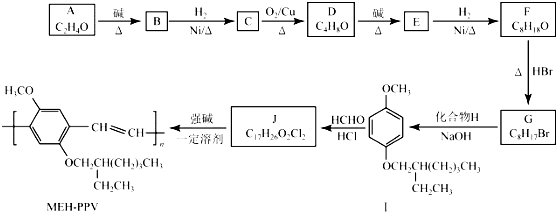
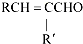 +H2O (R、R′表示烃基或氢)
+H2O (R、R′表示烃基或氢) (R、R′表示烃基烷氧基)
(R、R′表示烃基烷氧基)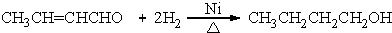 .
.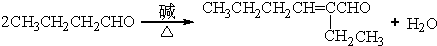 .
.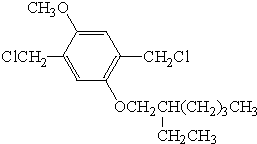 .
.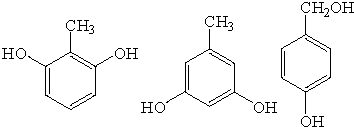 .
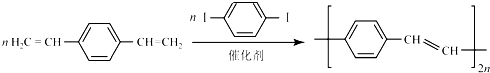
.
 、
、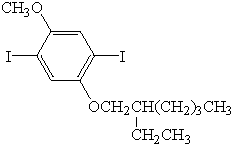 .
.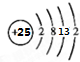 ,其最高正价为+7;位于元素周期表中第四周期ⅦB族.
,其最高正价为+7;位于元素周期表中第四周期ⅦB族.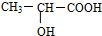 ,回答下列问题:
,回答下列问题: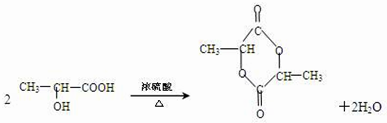
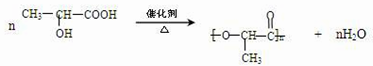
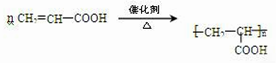 .
. ;
;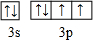 .
.