题目内容
9.下列关于0.01mol•L-1(NH4)2Fe(SO4)2溶液的说法正确的是( )| A. | 25℃时,加水稀释后,n(H+)•n(OH-)的乘积不变 | |
| B. | 离子浓度关系:3c(Fe3+)+c(NH4+)+c(H+)=c(OH-)+2c(SO42-) | |
| C. | 溶液呈酸性是因为NH4++H2O?NH3H2O+H+ | |
| D. | 温度升高(假设溶液的体积没有变化)溶液的pH增大 |
分析 A、水的离子积Kw只和温度有关,但加水稀释后,溶液体积变大;
B、根据(NH4)2Fe(SO4)2溶液中铁元素为Fe2+的形式存在来分析;
C、NH4+是弱碱阳离子,在溶液中水解显酸性;
D、盐类的水解吸热.
解答 解:A、水的离子积Kw=c(H+)•c(OH-)只和温度有关,但加水稀释后,溶液体积变大,故n(H+)•n(OH-)的乘积增大,故A错误;
B、由于(NH4)2Fe(SO4)2溶液中铁元素为Fe2+的形式存在,根据电荷守恒可知有:2c(Fe2+)+c(NH4+)+c(H+)=c(OH-)+2c(SO42-),故B错误;
C、Fe2+和NH4+均为弱碱阳离子,在溶液中水解均显酸性,故溶液呈酸性和NH4++H2O?NH3•H2O+H+有关,故C正确;
D、盐类的水解吸热,故升高温度,盐类的水解被促进,则溶液的酸性增强,故pH减小,故D错误.
故选C.
点评 本题考查了加水稀释、升高温度等对盐类水解的影响,难度不大,应注意的是(NH4)2Fe(SO4)2溶液中铁元素为Fe2+的形式存在.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列实验操作和结论错误的是( )
| A. | 用新制Cu(OH)2可鉴别麦芽糖和蔗糖 | |
| B. | 用银镜反应可证明淀粉是否转化为葡萄糖,但不能证明是否完全转化 | |
| C. | 浓H2SO4可使蔗糖脱水变黑,证明蔗糖含C,H,O三种元素 | |
| D. | 蔗糖溶液中滴加几滴稀H2SO4后,水溶加热几分钟,加入到银氨溶液中,不能发生银镜反应,证明蔗糖不水解 |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 17g羟基与17g NH3所含电子数均为10NA | |
| B. | lmolCl2溶于水转移电子数为NA | |
| C. | 1L0.1mol•L-1 NH4 HC03溶液中所含NH4+数为0.1NA | |
| D. | 标准状况下,11.2LN2和02混合气体中所含分子数为0.5NA |
20.硫酸亚铁铵又称莫尔盐,是浅绿色晶体.它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂.某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度.
已知:
①
②莫尔盐在乙醇溶剂中难溶.
Ⅰ.莫尔盐的制取

试分析:
(1)步骤2中加热方式 (填“直接加热”“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出.
(2)步骤3中包含的实验操作名称加热浓缩、冷却结晶.
(3)产品莫尔盐最后用b洗涤(填字母编号).
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4FeSO46H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00mL硫酸亚铁铵溶液用0.1000molL -1的酸性KMnO4溶液分三次进行滴定.
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如下实验.

(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为Fe2+已被空气部分氧化,验证推测的方法为:取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化.
(丙)方案三:(通过NH 4+测定)实验设计图如下所示.取20.00mL硫酸亚铁铵溶液进行该实验.
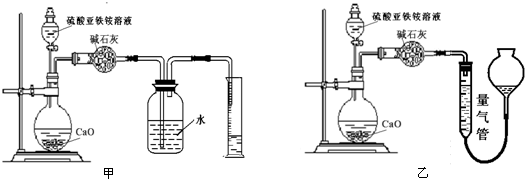
(2)①装置乙(填“甲”或“乙”)较为合理,判断理由是甲装置会出现倒吸.量气管中最佳试剂是 (填字母编号.如选“乙”则填此空,如选“甲”此空可不填).
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为$\frac{392V×25}{44.8m}$×100%.
已知:
①
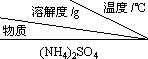 | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4•FeSO4•6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
Ⅰ.莫尔盐的制取

试分析:
(1)步骤2中加热方式 (填“直接加热”“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出.
(2)步骤3中包含的实验操作名称加热浓缩、冷却结晶.
(3)产品莫尔盐最后用b洗涤(填字母编号).
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4FeSO46H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00mL硫酸亚铁铵溶液用0.1000molL -1的酸性KMnO4溶液分三次进行滴定.
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如下实验.

(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为Fe2+已被空气部分氧化,验证推测的方法为:取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化.
(丙)方案三:(通过NH 4+测定)实验设计图如下所示.取20.00mL硫酸亚铁铵溶液进行该实验.

(2)①装置乙(填“甲”或“乙”)较为合理,判断理由是甲装置会出现倒吸.量气管中最佳试剂是 (填字母编号.如选“乙”则填此空,如选“甲”此空可不填).
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为$\frac{392V×25}{44.8m}$×100%.
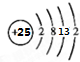 ,其最高正价为+7;位于元素周期表中第四周期ⅦB族.
,其最高正价为+7;位于元素周期表中第四周期ⅦB族.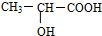 ,回答下列问题:
,回答下列问题:
 .
.