题目内容
11. 在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )
在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )| A. | “彩雾”是一种混合物 | |
| B. | 上述过程中有物理变化 | |
| C. | 燃料燃烧产生的热量促使拉烟剂气化 | |
| D. | “彩雾”的形成与焰色反应的原理相同 |
分析 A.混合物是两种或两种以上的物质组成,纯净物是单一的一种物质;
B.化学变化是指有新物质生成的变化.物理变化是指没有新物质生成的变化;
C.燃烧是放热过程;
D.“彩雾”的形成过程显色是拉烟剂的原因.
解答 解:A.“彩雾”中包括水蒸气和气化后的彩色拉烟剂,因此是混合物,故A正确;
B.“彩雾”形成过程是高温气体中的水蒸气与气化后的拉烟剂遇冷凝结形成的,是物理变化,故B正确;
C.飞机燃料燃烧产热使得拉烟剂气化,故C正确;
D.“彩雾”的形成过程显色是拉烟剂的原因,与焰色反应无关,故D错误.
故选D.
点评 本题主要考查的是物质分类和变化的分类问题,题目难度不大,注意明确相关的概念及分类方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
1.可用来鉴别乙烯、四氯化碳、苯的试剂是( )
| A. | 酸性高锰酸钾 | B. | 溴水 | ||
| C. | 液溴 | D. | 浓硝酸和浓硫酸混合液 |
2.我国探月的目的之一是探测月球土壤厚度和3He的资源量.3He是最安全最清洁的能源,地球上仅有15t左右,而月球上的3He估计在1.0×106 t~1.5×106 t.下列关于3He的说法错误的是( )
| A. | 核内有2个质子 | B. | 与4He互为同位素 | ||
| C. | 核内有1个中子 | D. | 是4He的同素异形体 |
6.雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等.
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.反应的化学方程式为2NO(g)+2CO( g)?N2( g)+2CO2(g).
①已知部分化学键的键能如下:
请计算上述反应的△H=-538kJ/mol
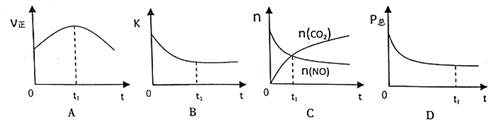
②若上述反应在恒温、恒容的密闭体系中进行,并在t.时刻达到平衡状态,则下列示意图不符合题意的是ABC(填选项字母).(下图中V正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
③在T℃下,向体积为10L的恒容密闭容器中通人NO和CO,测得了不同时间时NO和CO的物质的量如下表:
T℃时该反应的平衡常数K=500,既能增大反应速率又能使平衡正向移动的措施是加压(写出一种即可).
(2)是硫酸工业释放出的主要尾气,为减少对环境造成的影响,采用以下方法将其资源化利用,重新获得重要工业产品硫化钙.
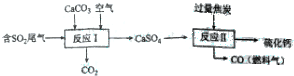
①写出反应的化学方程式2CaCO3+O2+2SO2=2CaSO4+2CO2.
②反应中每生成1mol硫化钙理论上转移电子数为8NA.
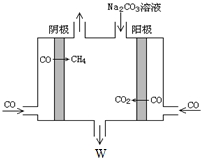
③为充分利用副产品CO,设计电解CO制备CH4和W,工作原理如图所示,生成物W是NaHCO3,其原理用电解总离子方程式解释是4CO+3CO32-+5H2O=6HCO3-+CH4↑.
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.反应的化学方程式为2NO(g)+2CO( g)?N2( g)+2CO2(g).
①已知部分化学键的键能如下:
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
②若上述反应在恒温、恒容的密闭体系中进行,并在t.时刻达到平衡状态,则下列示意图不符合题意的是ABC(填选项字母).(下图中V正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)

③在T℃下,向体积为10L的恒容密闭容器中通人NO和CO,测得了不同时间时NO和CO的物质的量如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n(CO)/×10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(2)是硫酸工业释放出的主要尾气,为减少对环境造成的影响,采用以下方法将其资源化利用,重新获得重要工业产品硫化钙.

①写出反应的化学方程式2CaCO3+O2+2SO2=2CaSO4+2CO2.
②反应中每生成1mol硫化钙理论上转移电子数为8NA.
③为充分利用副产品CO,设计电解CO制备CH4和W,工作原理如图所示,生成物W是NaHCO3,其原理用电解总离子方程式解释是4CO+3CO32-+5H2O=6HCO3-+CH4↑.

3.现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )
| A. | 最高正化合价:③>②>① | B. | 单质氧化性:③>①>② | ||
| C. | 电负性:③>②>① | D. | 原子半径:③>②>① |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 17g羟基与17g NH3所含电子数均为10NA | |
| B. | lmolCl2溶于水转移电子数为NA | |
| C. | 1L0.1mol•L-1 NH4 HC03溶液中所含NH4+数为0.1NA | |
| D. | 标准状况下,11.2LN2和02混合气体中所含分子数为0.5NA |
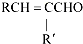 +H2O (R、R′表示烃基或氢)
+H2O (R、R′表示烃基或氢) (R、R′表示烃基烷氧基)
(R、R′表示烃基烷氧基)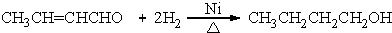 .
.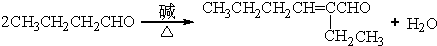 .
.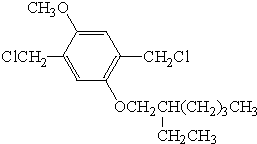 .
.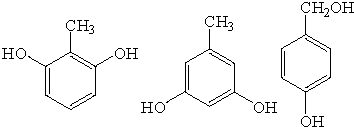 .
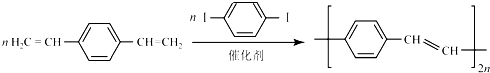
.
 、
、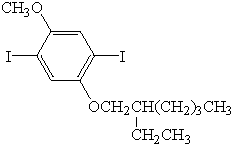 .
.