题目内容
16.某研究性学习小组通过下列反应原理制备SO2并进行性质探究.反应原理为:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O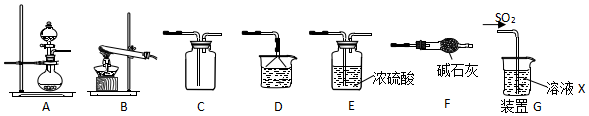
(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为AECED或AECD或AECF.
(2)D中盛装的试剂为NaOH溶液.
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的氧化性,可观察到的现象产生黄色沉淀.
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4,为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
| 实验 | 操作 | 现象 | 结论和解释 |
| 2 | 将SO2通入0.1mol/LFeCl3和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
| 3 | 将SO2通入0.01mol/LHNO3 和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3-能将H2SO3氧化为SO42- |
(6)丁同学在实验2过程发现,黄色溶液先变红棕色后慢慢变浅绿色,查阅资料得:Fe3++6SO2?Fe(SO2)63+(红棕色).请用化学平衡移动原理解释实验2中溶液颜色变化的原因反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(反应①)较Fe3++6SO2?Fe(SO2)63+(反应②)反应缓慢,故先发生反应②,然后发生反应①,但反应①的限度较大,故溶液中c(Fe3+)慢慢降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
分析 解:(1)反应原理为:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O,根据上述原理制备并收集干燥SO2的实验装置选择A为发生装置,生成二氧化硫中含水蒸气,通过装置E中的浓硫酸干燥二氧化硫气体,通过装置C收集二氧化硫气体,剩余气体不能排放需要通过装置D或F吸收;
(2)D中是吸收多余的二氧化硫气体,应用氢氧化钠溶液;
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,则二氧化硫和硫化钠发生氧化还原反应生成硫单质;
(4)乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4,铁离子氧化二氧化硫生成硫酸,结合钡离子生成硫酸钡沉淀,二氧化硫通入硝酸的氯化钡溶液中,稀硝酸氧化二氧化硫为硫酸生成硫酸钡沉淀;
(5)丙同学认为以上实验只能说明Fe3+和酸性条件下NO3-均能将H2SO3氧化为SO42-,不能说明谁先氧化H2SO3,他利用提供的试剂(限选试剂:KSCN溶液,K3[Fe(CN)6]溶液,苯酚溶液,硝酸溶液)设计实验方案探究何种微粒先发生反应,取乙同学实验1后装置G中烧杯的上层清液于试管中,加入往试管中滴加铁氰化钾溶液,若溶液出现蓝色沉淀,则证明是Fe3+先氧化H2SO3,若溶液没有明显现象,则证明是pH=2的HNO3先氧化H2SO3;
(6)反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(反应①)较Fe3++6SO2?Fe(SO2)63+(反应②)反应缓慢,故先发生反应②,然后发生反应①,但反应①的限度较大,据此分析.
解答 解:(1)反应原理为:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O,根据上述原理制备并收集干燥SO2的实验装置选择A为发生装置,生成二氧化硫中含水蒸气,通过装置E中的浓硫酸干燥二氧化硫气体,通过装置C收集二氧化硫气体,剩余气体不能排放需要通过装置D或F吸收,制备并收集干燥SO2的实验装置连接顺序为:AECED 或AECD或AECF,
故答案为:AECED 或AECD或AECF;
(2)D装置是吸收多余的二氧化硫气体,D中盛装的试剂为氢氧化钠溶液,
故答案为:NaOH溶液;
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,则二氧化硫和硫化钠发生氧化还原反应生成硫单质,反应的化学方程式为:2Na2S+SO2+2H2O=3S+4NaOH,表现了二氧化硫的氧化性,反应现象为生成黄色沉淀,
故答案为:氧化性;产生黄色沉淀;
(4)乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4,铁离子氧化二氧化硫生成硫酸,结合钡离子生成硫酸钡沉淀,二氧化硫通入硝酸的氯化钡溶液中,稀硝酸氧化二氧化硫为硫酸生成硫酸钡沉淀;
将SO2通入0.1mol/L FeCl3和BaCl2混合液产生白色沉淀,是Fe3+能氧化H2SO3 ,将SO2通入0.01mol/L HNO3 和 BaCl2混合液,产生白色沉淀酸性条件NO3-能将H2SO3氧化为SO42-,
故答案为:FeCl3;0.01mol/L HNO3;
(5)丙同学认为以上实验只能说明Fe3+和酸性条件下NO3-均能将H2SO3氧化为SO42-,不能说明谁先氧化H2SO3,他利用提供的试剂(限选试剂:KSCN溶液,K3[Fe(CN)6]溶液,苯酚溶液,硝酸溶液)设计实验方案探究何种微粒先发生反应,取乙同学实验1后装置G中烧杯的上层清液于试管中,往试管中滴加铁氰化钾溶液,若溶液出现蓝色沉淀,则证明是Fe3+先氧化H2SO3,若溶液没有明显现象,则证明是pH=2的HNO3先氧化H2SO3,
故答案为:往试管中滴加铁氰化钾溶液,若溶液出现蓝色沉淀,则证明是Fe3+先氧化H2SO3,若溶液没有明显现象,则证明是pH=2的HNO3先氧化H2SO3;
(6)丁同学在实验2过程发现,黄色溶液先变红棕色后慢慢变浅绿色,查阅资料得:Fe3++6SO2?Fe(SO2)63+(红棕色).请用化学平衡移动原理解释实验2中溶液颜色变化的原因是:反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(反应①)较Fe3++6SO2?Fe(SO2)63+(反应②)反应缓慢,故先发生反应②,然后发生反应①,但反应①的限度较大,故溶液中c(Fe3+)慢慢降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液,
故答案为:反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(反应①)较Fe3++6SO2?Fe(SO2)63+(反应②)反应缓慢,故先发生反应②,然后发生反应①,但反应①的限度较大,故溶液中c(Fe3+)慢慢降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
点评 本题考查了化学实验设计、物质性质鉴别、反应现象的分析判断、氧化还原反应的应用等知识点,掌握基础是解题关键,题目难度中等.

| A. | 干冰 | B. | 食盐 | C. | 碳化硅 | D. | 金刚石 |
| A. | SO3 | B. | NO2 | C. | CO2 | D. | SO2 |
 X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法不正确的是( )
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法不正确的是( )| A. | R的氧化物都含有离子键 | B. | 最高价含氧酸的酸性:Z<Y | ||
| C. | M的氢化物常温常压下为气体 | D. | Y形成的化合物种类最多 |
 ,有关该化合物的下列说法错误的是( )
,有关该化合物的下列说法错误的是( )| A. | 分子式为C12H18O2 | |
| B. | 分子中至少有6个碳原子共平面 | |
| C. | 该化合物能使酸性高锰酸钾褪色 | |
| D. | 一定条件下,1mol该化合物最多可与3mol H2加成 |
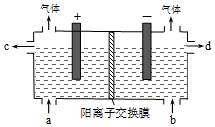 用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )
用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )| A. | 通电后阳极区溶液pH增大 | |
| B. | 阴极区的电极反应式为4OH--4e-=O2↑+2H2O | |
| C. | 当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成 | |
| D. | 通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出 |
| A. | 钢管与电源正极连接,钢管不易被腐蚀 | |
| B. | 通常情况下,钢管的电化腐蚀主要是吸氧腐蚀 | |
| C. | 钢管与铜管露天堆放在一起,钢管不易被腐蚀 | |
| D. | 钢管发生析氢腐蚀时,负极反应是Fe-3e→Fe3+ |
| 序号 | 实验步骤和结论 |
| ① | 比较浓度均为0.1mol•L-1的A和E的pH的大小为:7<A<E |
| ② | 1L pH=9的A分别与x L 0.001mol•L-1 B,y L 0.001mol•L-1D充分反应后,当溶液均呈中性时x、y的大小关系为:y<x; |
| ③ | pH=a的C与pH=b的D,且a+b=14,等体积混合发生酸碱中和反应后,溶液呈碱性. |
(2)将等体积、等物质的量浓度的D、E分别与足量的铝粉反应,相同条件下产生氢气的体积之比为1:3.
(3)将等体积、等物质的量浓度的B和C混合后所得溶液的PH为7,又己知醋酸的酸性强于碳酸,由此可推断碳酸氢铵水溶液呈碱(填“酸”、“碱”或“中”)性.
(4)将D溶液逐滴滴加到A溶液中,当滴入的D的物质的量与A相等时,溶液中所有阴离子的物质的量浓度由大到小的关系为c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-).
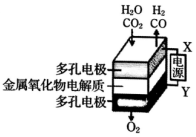 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | 阴极的反应式是:H2O+2e-=H2+O2-、CO2+2e-=CO+O2- | |
| B. | X是电源的负极 | |
| C. | 总反应可表示为:H2O+CO2=H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |