题目内容
13.表为元素周期表的一部分,X、Y、Z、R为短周期元素,其中Y元素的原子最外层电子数是其内层电子数的3倍,下列说法正确的是( )| X | Y | |
| Z | ′ | R |
| W |
| A. | 原子半径大小关系为:R>Y>X | |
| B. | X有多种同素异形体,而Y不存在同素异形体 | |
| C. | 根据元素周期律t可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性 | |
| D. | 氢化物熔沸点:H2R>H2Y |
分析 X、Y、Z、R为短周期元素,其Y元素的原子最外层电子数是其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素,由元素在周期表中的位置可知,X为C元素,Z为Si元素、W为As元素,R为S,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:X为C元素,Y为O、Z为Si元素、W为As元素,R为S,
A.电子层越多,原子半径越大,同周期原子序数大的半径小,则原子半径大小关系为:R>X>Y,故A错误;
B.碳元素有石墨、金刚石、C60等多种同素异形体,氧元素可以形氧气、臭氧,存在同素异形体,故B错误;
C.As位于金属与非金属的交界处,可知W元素的单质具有半导体特性,As元素的最高价化合价为+5价,则W2Y3具有氧化性和还原性,故C正确;
D.水分子间存在氢键,沸点高于硫化氢,故D错误.
故选C.
点评 本题考查位置、结构与性质的关系,为高频考点,把握原子结构、元素的位置与性质、元素周期律、元素化合物知识为解答的关键,综合性较强,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
3.在如图所示的微粒中,结合电子能力最强的是( )
| A. |  | B. |  | C. |  | D. |  |
4.下列符合图的实验是( )


| A. | 天然气燃烧 | B. | 浓硫酸倒入水中 | ||
| C. | 用氢气还原氧化铜 | D. | 铝热反应 |
1.下列说法中不正确的是( )
| A. | 光导纤维做通讯材料有许多优点,但怕腐蚀,铺设也很不方便 | |
| B. | 新型无机非金属材料具有光学特性、生物功能、电学特性、耐高温、强度高 | |
| C. | 高温结构陶瓷比金属材料具有许多优点,如耐高温不怕氧化、密度小等优点 | |
| D. | 光导纤维除用于通信外,还可以用于医疗、信息处理等许多方面 |
18.双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.下列有关双酚A的叙述不正确的是( )
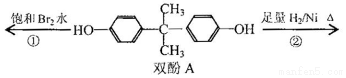

| A. | 双酚A的分子式是C15H16O2 | |
| B. | 反应①中,1mol双酚A最多消耗2mol Br2 | |
| C. | 反应②的产物中只有一种官能团 | |
| D. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 |
5.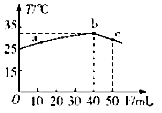 25℃时,向盛有50mLpH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示,下列叙述正确的是( )
25℃时,向盛有50mLpH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示,下列叙述正确的是( )
 25℃时,向盛有50mLpH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示,下列叙述正确的是( )
25℃时,向盛有50mLpH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示,下列叙述正确的是( )| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | c点表示酸碱恰好完全反应 | |
| C. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 | |
| D. | 等浓度的NaOH和NaA 混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>(H+) |
17.合金具有许多优良的物理、化学或机械性能.下列物质属于合金的是( )
| A. | 石墨 | B. | 陶瓷 | C. | 青铜 | D. | 水银 |
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.