题目内容
4.下列符合图的实验是( )
| A. | 天然气燃烧 | B. | 浓硫酸倒入水中 | ||
| C. | 用氢气还原氧化铜 | D. | 铝热反应 |
分析 由图可知反应中生成物总能量高于反应物总能量,是吸热反应,而常见的吸热反应有:绝大多数的分解反应;铵盐和碱的反应;以C、氢气或CO为还原剂的氧化还原反应等,以此解答该题.
解答 解:该反应为吸热反应,
A.天然气燃烧放出大量的热,为放热反应,故A错误;
B.浓硫酸倒入水中,放出热量,且不属于化学变化,故B错误;
C.用氢气还原氧化铜,为吸热反应,故C正确;
D.铝热反应为放热反应,故D错误.
故选C.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查学生的分析能力和双基的掌握,有利于培养学生良好的科学素养,难度不大,注意常见吸热反应与放热反应的类型.

练习册系列答案
相关题目
14.有机物X是合成二氢荆芥内酯的重要原料,其结构简式为 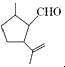 ,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
 ,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )| A. | 先加酸性高锰酸钾溶液,后加银氨溶液,加热 | |
| B. | 先加溴水,后加酸性高锰酸钾溶液 | |
| C. | 先加银氨溶液,加热,再加入溴水 | |
| D. | 先加入新制氢氧化铜悬浊液,加热,取清液酸化后再加溴水 |
12.下列叙述不正确的是( )
①热稳定性:H2O>HF>H2S
②熔点:Li>Na>K
③第I A、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3.
①热稳定性:H2O>HF>H2S
②熔点:Li>Na>K
③第I A、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3.
| A. | ①②⑤ | B. | ①③④ | C. | ①②③⑤ | D. | ①③⑤ |
19.某脂肪族化合物A的相对分子质量为118,其中C的质量分数为41%,H为5%,O为54%.化合物A能与碳酸氢钠溶液反应放出气体,也能与新制氧氧化铜悬浊液反应生成砖红色沉淀,符合条件的A的醇羟基同分异构体有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
9.在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的$\frac{1}{2}$,当达到新平衡时,C的浓度为原来的1.5倍,下列说法正确的是( )
| A. | m+n>p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率减小 | D. | C的体积分数增加 |
16.实现下列变化时,需克服相同类型作用力的是( )
| A. | 水晶和干冰的熔化 | B. | 食盐和碘的熔化 | ||
| C. | 金刚石和白磷的熔化 | D. | 纯碱和烧碱的熔化 |
13.表为元素周期表的一部分,X、Y、Z、R为短周期元素,其中Y元素的原子最外层电子数是其内层电子数的3倍,下列说法正确的是( )
| X | Y | |
| Z | ′ | R |
| W |
| A. | 原子半径大小关系为:R>Y>X | |
| B. | X有多种同素异形体,而Y不存在同素异形体 | |
| C. | 根据元素周期律t可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性 | |
| D. | 氢化物熔沸点:H2R>H2Y |

 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O.
+H2O. 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.