题目内容
5.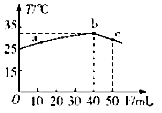 25℃时,向盛有50mLpH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示,下列叙述正确的是( )
25℃时,向盛有50mLpH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示,下列叙述正确的是( )| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | c点表示酸碱恰好完全反应 | |
| C. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 | |
| D. | 等浓度的NaOH和NaA 混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>(H+) |
分析 A.当酸碱中和恰好完全时,溶液中的溶质为NaA,根据物料守恒c(A-)与c(HA)之和始终等于钠离子浓度,若酸过量或碱过量时不再相等;
B.恰好中和时混合溶液温度最高,结合图象曲线变化判断;
C.电离平衡常数K=$\frac{c({H}^{+})c({A}^{-})}{c(HA)}$计算得到判断;
D.根据物料守恒,等浓度的NaOH和NaA混合溶液中c(Na+)>c(OH-)>c(A-)>c(H+).
解答 解:A.当酸碱中和恰好完全时,溶液中的溶质为NaA,根据物料守恒c(A-)+c(HA)=c(Na+),若酸过量或碱过量时不再相等,故A错误;
B.恰好中和时混合溶液温度最高,根据图象可知b点温度最高,则b点酸碱恰好完全反应,故B错误;
C.电离平衡常数K=$\frac{c({H}^{+})c({A}^{-})}{c(HA)}$=$\frac{0.01mol/L×0.01mol/L}{0.08mol/L-0.01mol/L}$=1.43×10-3,故C正确;
D.根据物料守恒,等浓度的NaOH和NaA混合溶液中c(Na+)>c(OH-)>c(A-)>c(H+),故D错误.
故选C.
点评 本题考查酸碱混合的定性判断和计算,题目结合中和反应考查了同学们观察分析问题的能力,以及利用化学方程式计算的能力,比较综合.

练习册系列答案
相关题目
16.实现下列变化时,需克服相同类型作用力的是( )
| A. | 水晶和干冰的熔化 | B. | 食盐和碘的熔化 | ||
| C. | 金刚石和白磷的熔化 | D. | 纯碱和烧碱的熔化 |
13.表为元素周期表的一部分,X、Y、Z、R为短周期元素,其中Y元素的原子最外层电子数是其内层电子数的3倍,下列说法正确的是( )
| X | Y | |
| Z | ′ | R |
| W |
| A. | 原子半径大小关系为:R>Y>X | |
| B. | X有多种同素异形体,而Y不存在同素异形体 | |
| C. | 根据元素周期律t可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性 | |
| D. | 氢化物熔沸点:H2R>H2Y |
4.请参考题中图表,已知E1=134kJ•mol-1、E2=368kJ•mol-1,根据要求回答问题:
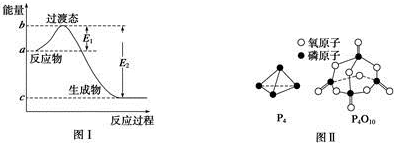
(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知③H2O(g)=H2O(l)△H=-44kJ•mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-764.7KJ/mol.
(3)如表所示是部分化学键的键能参数:
已知白磷的燃烧热为d kJ•mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=$\frac{6a+5c+d-12b}{4}$ kJ•mol-1(用含a、b、c、d的代数式表示).

(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知③H2O(g)=H2O(l)△H=-44kJ•mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-764.7KJ/mol.
(3)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
9.黄酒又叫老酒,越陈越香,越陈越好,因为黄酒中醇与有机酸反应.该过程中发生的反应为( )
| A. | 取代反应 | B. | 氧化反应 | C. | 加成反应 | D. | 加聚反应 |

 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O.
+H2O. +H2C=CH2$\stackrel{一定条件}{→}$
+H2C=CH2$\stackrel{一定条件}{→}$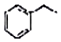
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$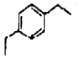
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$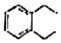
 .
.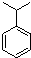 ,N:
,N: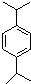 .
. 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.