题目内容
1.下列说法中不正确的是( )| A. | 光导纤维做通讯材料有许多优点,但怕腐蚀,铺设也很不方便 | |
| B. | 新型无机非金属材料具有光学特性、生物功能、电学特性、耐高温、强度高 | |
| C. | 高温结构陶瓷比金属材料具有许多优点,如耐高温不怕氧化、密度小等优点 | |
| D. | 光导纤维除用于通信外,还可以用于医疗、信息处理等许多方面 |
分析 A.光导纤维的主要成分是二氧化硅;
B.新型无机非金属材料主要有先进陶瓷、非晶体材料、人工晶体、无机涂层、无机纤维等;
C.高温结构陶瓷不怕氧化、密度小;
D.光导纤维可以用于医疗、信息处理.
解答 解:A.光导纤维的主要成分是二氧化硅,二氧化硅性质稳定,耐腐蚀,故A错误;
B.新型无机非金属材料主要有先进陶瓷、非晶体材料、人工晶体、无机涂层、无机纤维等,具有光学特性、生物功能、电学特性、耐高温、强度高,故B正确;
C.高温结构陶瓷包括高温氧化物和高温非氧化物(或称难熔化合物)两大类,不怕氧化,密度小,故C正确;
D.光导纤维在信息传递方面有很多应用,如内窥镜、光纤通信等,故D正确.
故选A.
点评 本题考查硅和二氧化硅的性质和用途,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.

练习册系列答案
相关题目
11.NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.5mol C4H10中含有的共价键数为6.5NA | |
| B. | 3.4 g羟基和3.4 g氢氧根均含有2NA个电子 | |
| C. | 1L0.1 mol•L-1CH3COOH溶液中含有的氧原子数为0.2NA | |
| D. | 标准状况下,22.4L由CHCl3和CH2Cl2组成的混合物中含有的分子数目为NA |
12.下列叙述不正确的是( )
①热稳定性:H2O>HF>H2S
②熔点:Li>Na>K
③第I A、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3.
①热稳定性:H2O>HF>H2S
②熔点:Li>Na>K
③第I A、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3.
| A. | ①②⑤ | B. | ①③④ | C. | ①②③⑤ | D. | ①③⑤ |
9.在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的$\frac{1}{2}$,当达到新平衡时,C的浓度为原来的1.5倍,下列说法正确的是( )
| A. | m+n>p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率减小 | D. | C的体积分数增加 |
16.实现下列变化时,需克服相同类型作用力的是( )
| A. | 水晶和干冰的熔化 | B. | 食盐和碘的熔化 | ||
| C. | 金刚石和白磷的熔化 | D. | 纯碱和烧碱的熔化 |
13.表为元素周期表的一部分,X、Y、Z、R为短周期元素,其中Y元素的原子最外层电子数是其内层电子数的3倍,下列说法正确的是( )
| X | Y | |
| Z | ′ | R |
| W |
| A. | 原子半径大小关系为:R>Y>X | |
| B. | X有多种同素异形体,而Y不存在同素异形体 | |
| C. | 根据元素周期律t可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性 | |
| D. | 氢化物熔沸点:H2R>H2Y |
4.请参考题中图表,已知E1=134kJ•mol-1、E2=368kJ•mol-1,根据要求回答问题:
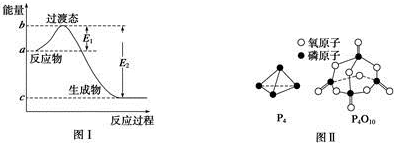
(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知③H2O(g)=H2O(l)△H=-44kJ•mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-764.7KJ/mol.
(3)如表所示是部分化学键的键能参数:
已知白磷的燃烧热为d kJ•mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=$\frac{6a+5c+d-12b}{4}$ kJ•mol-1(用含a、b、c、d的代数式表示).

(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知③H2O(g)=H2O(l)△H=-44kJ•mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-764.7KJ/mol.
(3)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
5.化学与生产、生活、社会密切相关.下列说法中,正确的是( )
| A. | 食用醋就是冰醋酸 | B. | 医用酒精浓度为75% | ||
| C. | 钢铁生锈主要是发生了析氢腐蚀 | D. | 汽车尾气的排放会引起臭氧空洞 |