题目内容
8.烟气中的氮氧化物(NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气污染.在25℃,101kPa下,1molO3与烟气中的NO完全反应生成NO2,同时放热317.3kJ.请计算:(1)标准状况下,1m3烟气中含NO 0.224L,要处理3m3烟气中的NO,需O3的体积.
(2)上述 O3与NO在25℃,101kPa下,完全反应时产生的热量.
分析 25℃,101kPa下,1molO3与烟气中的NO完全反应生成NO2,同时放热317.3kJ,该反应的热化学方程式为:NO(g)+O3(g)═NO2(g)+O2(g)△H=-317.3kJ•mol-1,
(1)3m3烟气中含有NO的体积为0.224L×3=0.672L,根据反应NO(g)+O3(g)═NO2(g)+O2(g)计算;
(2)根据n=$\frac{V}{{V}_{m}}$计算出0.672L臭氧的物质的量,然后结合热化学方程式计算放出热量.
解答 解:(1)标况下1m3烟气中含NO 0.224L,3m3烟气中含有NO的体积为0.224L×3=0.672L,根据反应NO(g)+O3(g)═NO2(g)+O2(g)可知消耗臭氧的体积为:
0.672L,
答:要处理3m3烟气中的NO,需O3的体积为0.672L;
(2)标况下0.672L臭氧的物质的量为:$\frac{0.672L}{22.4L/mol}$=0.03mol,根据反应NO(g)+O3(g)═NO2(g)+O2(g)△H=-317.3kJ•mol-1可知,消耗0.03mol臭氧放出热量为:317.3kJ•mol-1×0.03mol=9.519kJ,
答:0.03molO3与NO在25℃,101kPa下,完全反应时产生的热量为9.519kJ.
点评 本题考查化学方程式的计算、反应热的计算,题目难度不大,明确发生反应的实质为解答关键,注意熟练掌握物质的量与其它物理量之间的关系,试题有利于提高学生的化学计算能力.

练习册系列答案
相关题目
18.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 42gC3H6中含有的共用电子对数目为8NA | |
| B. | 由6gCaCO3和5gKHCO3组成的混合物中含有的碳原子数为0.11NA | |
| C. | 标准状况下,22.4L氯气和56g铁充分反应,转移的电子数为3NA | |
| D. | 1L0.01mol•L-1Kal(SO4)2溶液中含有的阳离子数为0.02NA |
19.某脂肪族化合物A的相对分子质量为118,其中C的质量分数为41%,H为5%,O为54%.化合物A能与碳酸氢钠溶液反应放出气体,也能与新制氧氧化铜悬浊液反应生成砖红色沉淀,符合条件的A的醇羟基同分异构体有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
16.实现下列变化时,需克服相同类型作用力的是( )
| A. | 水晶和干冰的熔化 | B. | 食盐和碘的熔化 | ||
| C. | 金刚石和白磷的熔化 | D. | 纯碱和烧碱的熔化 |
3.不能说明X的非金属性比Y强的是( )
| A. | X单质可以把Y从其氢化物中置换出来 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 与H2化合时X单质比Y单质容易 | |
| D. | X原子的最外层电子数比Y原子的最外层电子数多 |
13.表为元素周期表的一部分,X、Y、Z、R为短周期元素,其中Y元素的原子最外层电子数是其内层电子数的3倍,下列说法正确的是( )
| X | Y | |
| Z | ′ | R |
| W |
| A. | 原子半径大小关系为:R>Y>X | |
| B. | X有多种同素异形体,而Y不存在同素异形体 | |
| C. | 根据元素周期律t可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性 | |
| D. | 氢化物熔沸点:H2R>H2Y |
12.下列元素的基态原子中最难失去电子的是( )
| A. | F | B. | O | C. | Ne | D. | He |
 +H2C=CH2$\stackrel{一定条件}{→}$
+H2C=CH2$\stackrel{一定条件}{→}$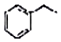
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$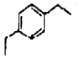
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$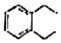
 .
.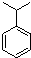 ,N:
,N: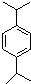 .
.