题目内容
 已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.
已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.(1)XH3+是有机反应的重要中间体,其空间构型为
(2)Z单质固态时属于
(3)相同条件下,X、Y的氢化物在水中溶解度较大的是
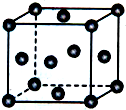
(4)W晶体的晶胞如图,W原子的配位数为
(5)若把上述立方晶胞中顶点上的W原子换成Au,可得到一种合金,该合金有储氢功能,储氢时,H原子进入到Au和W构成的四面体空隙中,则达到最大储氢量的化学式为
考点:晶胞的计算,位置结构性质的相互关系应用
专题:
分析:X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时的2p轨道上未成对的电子数最多,则Y是N元素,X的低价氧化物和Y单质分子的电子数相等,且X和Y相同周期,则X是C元素,X和Z同主族且属于短周期元素,所以Z是Si元素,W2+的核外电子排布式为[Ar]3d9,则W是Cu元素,据此答题;
解答:
解:X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时的2p轨道上未成对的电子数最多,则Y是N元素,X的低价氧化物和Y单质分子的电子数相等,且X和Y相同周期,则X是C元素,X和Z同主族且属于短周期元素,所以Z是Si元素,W2+的核外电子排布式为[Ar]3d9,则W是Cu元素,
(1)CH3+是有机反应的重要中间体,CH3+中价层电子对数是3且不含孤电子对,所以其空间构型为平面正三角形,其中C原子的杂化轨道类型为sp2,
故答案为:平面正三角形;sp2;
(2)Z是Si元素,Z的单质固态时属于原子晶体,X和Z形成的化合物的晶体熔点比Z单质的晶体熔点高,碳化硅和硅都是原子晶体,但硅硅键的键长大于碳硅键,所以碳化硅的熔点大于硅晶体,
故答案为:原子;碳化硅和硅都是原子晶体,但硅硅键的键长大于碳硅键;
(3)相同条件下,X、Y的最简单氢化物在水中溶解度较大的是NH3,主要原因是氨气和水分子间能形成氢键,从而促进氨气的溶解,甲烷和水不能形成氢键,且甲烷为非极性分子,所以甲烷不易溶于水,
故答案为:NH3;氨气和水分子间能形成氢键;
(4)根据规定Cu晶体的晶胞图可知,Cu原子的配位数为3×8×
=12,
故答案为:12;
(5)W为Cu,把晶胞中顶点上的Cu原子换成Au,晶胞中Cu和Au的原子个数比为1:3,在一个晶胞中Au和W构成的四面体空隙就有8个,每个空隙中进入一个H原子,一个晶胞中就可以有8个H原子,当达到最大储氢量时的化学式为AuCu3H8,故答案为:AuCu3H8;
(1)CH3+是有机反应的重要中间体,CH3+中价层电子对数是3且不含孤电子对,所以其空间构型为平面正三角形,其中C原子的杂化轨道类型为sp2,
故答案为:平面正三角形;sp2;
(2)Z是Si元素,Z的单质固态时属于原子晶体,X和Z形成的化合物的晶体熔点比Z单质的晶体熔点高,碳化硅和硅都是原子晶体,但硅硅键的键长大于碳硅键,所以碳化硅的熔点大于硅晶体,
故答案为:原子;碳化硅和硅都是原子晶体,但硅硅键的键长大于碳硅键;
(3)相同条件下,X、Y的最简单氢化物在水中溶解度较大的是NH3,主要原因是氨气和水分子间能形成氢键,从而促进氨气的溶解,甲烷和水不能形成氢键,且甲烷为非极性分子,所以甲烷不易溶于水,
故答案为:NH3;氨气和水分子间能形成氢键;
(4)根据规定Cu晶体的晶胞图可知,Cu原子的配位数为3×8×
| 1 |
| 2 |
故答案为:12;
(5)W为Cu,把晶胞中顶点上的Cu原子换成Au,晶胞中Cu和Au的原子个数比为1:3,在一个晶胞中Au和W构成的四面体空隙就有8个,每个空隙中进入一个H原子,一个晶胞中就可以有8个H原子,当达到最大储氢量时的化学式为AuCu3H8,故答案为:AuCu3H8;
点评:本题考查了晶胞的有关知识,正确推断元素是解本题关键,难点是配位数的判断,同时考查学生的空间想象能力,难度较大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
下列实验方案可行的是( )
A、检验溶液中是否有SO
| ||
| B、检验溶液中是否有K+时,用灼烧过的铂丝蘸取试液,观察焰色是否呈紫色 | ||
C、检验溶液中是否有NO
| ||
D、检验溶液中是否含有CO
|
下列分子中,原子的最外层电子不能都满足8电子稳定结构的是( )
| A、CO2 |
| B、Cl2 |
| C、H2O |
| D、PF3 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
| B、48g O3 和O2混合气体所含的原子数目为3NA |
| C、1mol氦气所含的电子数目为4NA |
| D、2.7g金属铝变成铝离子时失去的电子数目为0.1NA |
下列有关实验的说法正确的是( )
| A、用NH3?H2O溶液能鉴别Al3+、Mg2+、Ag+、Cu2+ |
| B、配制一定物质的量浓度的稀H2SO4时,量筒量取浓溶液时若俯视读数,结果偏低 |
C、如图实验 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 |
| D、测定中和热时:取25 mL 10 mol/L的浓硫酸和25 mL 10 mol/L的NaOH溶液中和,测定反应放出的热量 |
下列分子结构中,所有原子不能都满足最外层为8电子稳定结构的是( )
| A、CO2 |
| B、H2O |
| C、N2 |
| D、CCl4 |
 甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).
甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).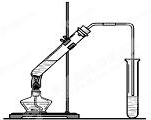 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: