题目内容
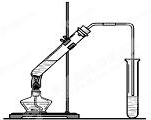 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:(1)装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
(2)该反应属于哪类反应类型
A.加成反应 B.取代反应 C.水解反应 D.酯化反应 E.可逆反应
(3)酯化反应的断键特点是:
(4)写出制取乙酸乙酯的化学反应方程式:
(5)为了证明浓硫酸的作用,某同学进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机物的厚度,实验记录如表:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、一定浓度的盐酸 | 饱和Na2CO3溶液 | 1.2 |
考点:乙酸乙酯的制取
专题:实验题
分析:(1)根据导管伸入液面下可能发生倒吸分析;
(2)该反应的方程式为CH3COOH+CH3CH2OH
CH3COOC2H5+H2O,属于可逆反应、酯化反应、取代反应;
(3)根据酯化反应的实质进行解答;
(4)乙酸与乙醇在浓硫酸作用下反应生成乙酸乙酯和水,据此写出反应的化学方程式;
(5)对比试验关键是要采用控制变量,即控制一个变量,其它条件不变,所以可以从控制变量的角度来分析解答.
(2)该反应的方程式为CH3COOH+CH3CH2OH
| 浓H2SO4 |
| △ |
(3)根据酯化反应的实质进行解答;
(4)乙酸与乙醇在浓硫酸作用下反应生成乙酸乙酯和水,据此写出反应的化学方程式;
(5)对比试验关键是要采用控制变量,即控制一个变量,其它条件不变,所以可以从控制变量的角度来分析解答.
解答:
解:(1)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:倒吸;
(2)乙酸与乙醇的酯化反应方程式为:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O,该反应为可逆反应,既属于酯化反应,也是取代反应,所以BDE正确,
故答案为:BDE;
(3)酯化反应中,酸脱去羟基,醇气体羟基中氢原子生成酯和水,即:酸脱羟基醇脱氢,
故答案为:酸脱羟基醇脱氢;
(4)乙酸与乙醇生成乙酸乙酯的化学反应方程式为:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O.
(5)本题是研究实验D与实验C相对照,证明H+对酯化反应具有催化作用的条件,题中采用了一个变量,实验C3mol?L-1 H2SO4,实验D盐酸,所以达到实验目的,实验D与实验C中H+的浓度一样,实验C3mL乙醇、2mL乙酸、3mol?L-1 H2SO4,实验D3mL乙醇、2mL乙酸、盐酸,要保证溶液体积一致,才能保证乙醇、乙酸的浓度不变,盐酸体积为6mL,实验D与实验C中H+的浓度一样,所以盐酸的浓度为6mol?L-1,
故答案为:6,6.
故答案为:倒吸;
(2)乙酸与乙醇的酯化反应方程式为:CH3COOH+CH3CH2OH
| 浓H2SO4 |
| △ |
故答案为:BDE;
(3)酯化反应中,酸脱去羟基,醇气体羟基中氢原子生成酯和水,即:酸脱羟基醇脱氢,
故答案为:酸脱羟基醇脱氢;
(4)乙酸与乙醇生成乙酸乙酯的化学反应方程式为:CH3COOH+CH3CH2OH
| 浓H2SO4 |
| △ |
故答案为:CH3COOH+CH3CH2OH
| 浓H2SO4 |
| △ |
(5)本题是研究实验D与实验C相对照,证明H+对酯化反应具有催化作用的条件,题中采用了一个变量,实验C3mol?L-1 H2SO4,实验D盐酸,所以达到实验目的,实验D与实验C中H+的浓度一样,实验C3mL乙醇、2mL乙酸、3mol?L-1 H2SO4,实验D3mL乙醇、2mL乙酸、盐酸,要保证溶液体积一致,才能保证乙醇、乙酸的浓度不变,盐酸体积为6mL,实验D与实验C中H+的浓度一样,所以盐酸的浓度为6mol?L-1,
故答案为:6,6.
点评:本题考查了乙酸乙酯的制备,题目难度不大,注意把握乙酸乙酯的制备原理和实验方法,明确酯化反应中浓硫酸、饱和碳酸钠溶液的作用为解答本题的关键,(5)为易错点,明确对照试验的设计原则.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
已知X、Y是主族元素,I为电离能,单位是kJ?mol-1.请根据下表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 502 | 4 600 | 6 900 | 9 500 |
| Y | 588 | 1 820 | 2 750 | 11 600 |
| A、元素X的常见化合价是+1 |
| B、若元素Y处于第3周期,它可与冷水剧烈反应 |
| C、元素Y是ⅢA族元素 |
| D、元素X与氯形成化合物时,化学式可能是XCl |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| B、在熔融状态下,lmol NaHSO4完全电离出的阳离子数为2NA |
| C、5.6 g铁粉在2.24L(标准状况)氯气中充分燃烧,失去的电子数为0.3NA |
| D、78g Na2O2固体与H2O完全反应转移的电子数为NA |
某元素电子构型为[Xe]4f46s2,其应在( )
| A、s区 | B、p区 | C、d区 | D、f区 |
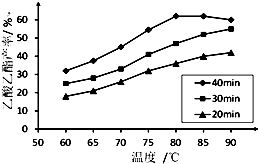 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯: 已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.
已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.


 )聚合而成,是一种多功能塑料,广泛应用于食品包装,机器设备等许多日常生活领域中.写出以D和苯为主要原料制备苯乙烯(
)聚合而成,是一种多功能塑料,广泛应用于食品包装,机器设备等许多日常生活领域中.写出以D和苯为主要原料制备苯乙烯( )的合成路线流程图,无机试剂任选.(合成路线常用表示方法为:A
)的合成路线流程图,无机试剂任选.(合成路线常用表示方法为:A