题目内容
 甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).
甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).(1)反应过程中物质能量变化如图所示.写出合成甲醇的热化学方程式
实验室在1L密闭容器中进行模拟合成实验.将1molCO和2molH2通入容器中,分别恒温在3000C和5000C反应,每隔一定时间测得容器中甲醇的浓度如下:
| 10min | 20min | 30min | 40min | 50min | 60min | ||
| 3000C | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 | |
| 5000C | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(3)5000C平衡常数K=
(4)在另一体积不变的容器中,充入1.2molCO和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半.该条件下H2转化率为
考点:化学平衡的计算,热化学方程式
专题:化学反应中的能量变化,化学平衡专题
分析:(1)由反应过程中物质能量变化图可知,1molCO(g)与2molH2(g)完全反应生成1molCH3OH(g)放出热量为(b-a)kJ,结合热化学方程式书写规则书写.
(2)由表可知10min内,甲醇的浓度变化为0.40mol/L,根据v=
计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2).
(3)由表可知40min时,反应达平衡状态,甲醇的平衡浓度为0.80mol/L.CO的起始浓度为1mol/L、H2的起始浓度为2mol/L,根据三段式计算出平衡时各组分的平衡浓度,代入平衡常数表达式计算.
(4)测得平衡时容器内压强为起始的一半,则平衡时混合气体的总物质的量为(1.2mol+2mol)×
=1.6mol,根据方程式利用差量法计算转化的一氧化碳的物质的量,转化的氢气的物质的量是一氧化碳的2倍,再利用转化率定义计算.
(2)由表可知10min内,甲醇的浓度变化为0.40mol/L,根据v=
| △c |
| △t |
(3)由表可知40min时,反应达平衡状态,甲醇的平衡浓度为0.80mol/L.CO的起始浓度为1mol/L、H2的起始浓度为2mol/L,根据三段式计算出平衡时各组分的平衡浓度,代入平衡常数表达式计算.
(4)测得平衡时容器内压强为起始的一半,则平衡时混合气体的总物质的量为(1.2mol+2mol)×
| 1 |
| 2 |
解答:
解:(1)由反应过程中物质能量变化图可知,1molCO(g)与2molH2(g)完全反应生成1molCH3OH(g)放出热量为(b-a)kJ,所以合成甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol,
故答案为:CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol;
(2)由表可知10min内,甲醇的浓度变化为0.40mol/L,所以v(CH3OH)=
=0.040mol/(L?min),速率之比等于化学计量数之比,所以v(H2)=2v(CH3OH)=2×0.040mol/(L?min)=0.080mol/(L?min),
故答案为:0.080mol/(L?min);
(3)由表可知40min时,反应达平衡状态,甲醇的平衡浓度为0.80mol/L,CO的起始浓度为1mol/L、H2的起始浓度为2mol/L,所以:
CO(g)+2H2(g)?CH3OH(g)
开始(mol/L):1 2 0
变化(mol/L):0.8 1.6 0.8
平衡(mol/L):0.2 0.4 0.8
所以500℃平衡常数k=
=25,
故答案为:25;
(4)充入1.2molCO2和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半,则平衡时混合气体的总物质的量为(1.2mol+2mol)×
=1.6mol,令转化的一氧化碳的物质的量为xmol,则:
CO(g)+2H2(g)?CH3OH(g)物质的量变化△n
1 2 2
x 2x 1.2mol+2mol-1.6mol=1.6mol
所以x=0.8mol
所以氢气的转化率为
×100%=80%.
故答案为:80%.
故答案为:CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol;
(2)由表可知10min内,甲醇的浓度变化为0.40mol/L,所以v(CH3OH)=
| 0.4mol/L |
| 10min |
故答案为:0.080mol/(L?min);
(3)由表可知40min时,反应达平衡状态,甲醇的平衡浓度为0.80mol/L,CO的起始浓度为1mol/L、H2的起始浓度为2mol/L,所以:
CO(g)+2H2(g)?CH3OH(g)
开始(mol/L):1 2 0
变化(mol/L):0.8 1.6 0.8
平衡(mol/L):0.2 0.4 0.8
所以500℃平衡常数k=
| 0.8 |
| 0.2×0.42 |
故答案为:25;
(4)充入1.2molCO2和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半,则平衡时混合气体的总物质的量为(1.2mol+2mol)×
| 1 |
| 2 |
CO(g)+2H2(g)?CH3OH(g)物质的量变化△n
1 2 2
x 2x 1.2mol+2mol-1.6mol=1.6mol
所以x=0.8mol
所以氢气的转化率为
| 0.8mol×2 |
| 2mol |
故答案为:80%.
点评:本题考查热化学方程式、化学平衡的计算等,是对所学知识的直接运用,难度中等,旨在考查学生对基础知识的掌握.

练习册系列答案
相关题目
摩尔是( )
| A、计量微观粒子的物质的量的单位 |
| B、表示物质质量的单位 |
| C、国际单位制的一个基本物理量 |
| D、表示6.02×1023个粒子的集体 |
下列有关化学用语错误的是( )
A、Na+的基态电子排布图是: |
B、H2O分子的电子式为: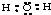 |
| C、Ca2+离子基态电子排布式为:1s22s22p63s23p6 |
D、氯原子结构示意图为: |
已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1
2CO(g)═2C(s)+O2(g)△H=+221kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(l)+2CO(g)△H为( )
2CO(g)═2C(s)+O2(g)△H=+221kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(l)+2CO(g)△H为( )
| A、-162 kJ?mol-1 |
| B、+81 kJ?mol-1 |
| C、+162 kJ?mol-1 |
| D、-81 kJ?mol-1 |
 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯: 已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.
已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.